Содержание
- Клинико-диагностическая лаборатория: объекты обработки
- ДЕЗИНФЕКЦИЯ ЛАБОРАТОРНОГО ИНСТРУМЕНТАРИЯ, ПОСУДЫ, СПЕЦОДЕЖДЫ, БИОМАТЕРИАЛА, ОБОРУДОВАНИЯ
- Стерилизация лабораторной посуды.
- Инструкция по мерам профилактики распространения инфекционных заболеваний при работе в клинико-диагностических лабораториях лечебно-профилактических учреждений
- Общие положения
- I. Основные правила работы в КДЛ
- II.Способы взятия крови
- III. Дезинфекция лабораторного инструментария, посуды, спецодежды, биоматериала, оборудования
- IV. Предстерилизационная очистка
- V. Режимы и условия стерилизации указаны в таблицах 3-5
- VI. Санитарное содержание помещений
- VII. Транспортировка и хранение биоматериала
Клинико-диагностическая лаборатория: объекты обработки
18 Апреля 2019
Санэпидрежим в клинико-диагностической лаборатории
Так, объектами дезинфекции в лаборатории являются:
1. Руки и открытые участки кожи медперсонала;
2. Лабораторная посуда и инструментарий;
3. Поверхности мебели и лабораторного оборудования;
4. Поверхности помещения;
5. Биологический материал и твердые отходы.
Дезинфекция лабораторной посуды и инструментов
Все лабораторные инструменты (иглы, шпатели и пр.) и лабораторная посуда (предметные стекла, пипетки, пробирки и пр.) после использования подвергают дезинфекционной обработке.
Для этого необходимо применять средства для дезинфекции изделий медицинского назначения, активные в отношении парентеральных вирусов, таковыми являются дезсредства «Септолит Тетра» и «Септолит ДХЦ».
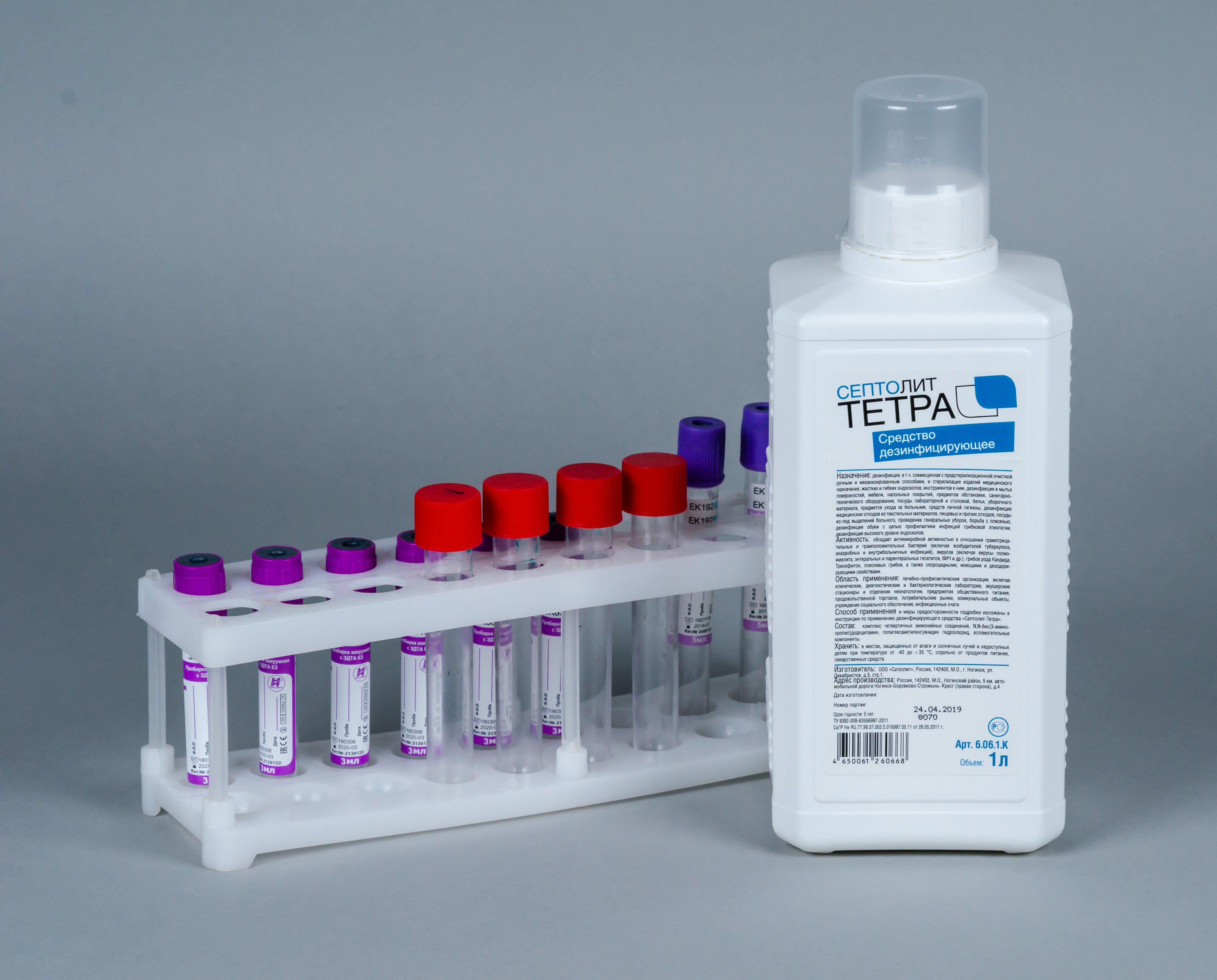
Лабораторную посуду и инструменты дезинфицируют путем погружения в раствор дезсредства. По окончанию времени экспозиции проводят предстерилизационную очистку— путем очищения инструментов и посуды в растворе дезсредства с помощью щеточек. После этого изделия промывают проточной водой, просушивают. В завершении лабораторные изделия отправляют на стерилизацию паровым или воздушным методом.
Одноразовый инструментарий обеззараживают в растворе дезсредства, а затем утилизируют.
Дезинфекция биологических материалов
Отобранный биологический материал (кровь, моча, кал, мокрота) после проведения исследования подлежит дезинфекции. Для обеззараживания биоматериалов необходимо использовать хлорсодержащие дезсредства, например, дезсредство «Септолит ДХЦ». Рабочий раствор которого готовят путем растворения хлорных таблеток в воде.
Находящиеся в емкостях кал, рвотные массы, мочу заливают раствором «Септолит ДХЦ» в соотношении 1 к 2. По окончанию времени экспозиции выделения утилизируют. По такому же принципу в отдельных емкостях дезинфицируют и кровь.
Емкости, используемые под выделения также необходимо дезинфицировать, и делают это путем погружения их в раствор дезсредства. По окончанию дезобработки емкости ополаскивают водой.
Дезинфекция мебели и оборудования
Рабочие столы и оборудование в конце смены обязательно протирают ветошью, смоченной в дезсредство. Для дезинфекции мебели и медоборудования рекомендуем использовать такие современные средства дезинфекции:
1. Дезсредство с моющими свойствами «Септолит Лайт»;
2. Концентрированное дезсредство с моющими свойствами «Септолит Плюс»;
3. Хлорсодержащее дезсредство «Септолит ДХЦ».
При разлитии крови на стол необходимо моментально обработать его поверхность хлорсодержащим дезсредством, например, дезсредством «Септолит ДХЦ». Для этого пролившуюся кровь промокают ветошью, смоченной в растворе дезсредства. Использованную ветошь погружают в емкость с дезсредством. В завершении поверхность вытирают чистой ветошью, смоченной в дезсредстве.
Также медперсонал лаборатории должен четко знать, как нужно действовать в случае возникновения аварийных ситуаций. Так, в ситуации с разрушением пробирок с материалами во время центрифугирования к осуществлению аварийных мероприятий приступают спустя сорок минут, когда аэрозоль полностью осядет на поверхность оборудования.
В гнездо ротора центрифуги на один час заливают раствор дезсредства, а по истечению времени содержимое гнезда переливают в сосуд с дезсредством. Затем центрифугу полностью протирают ветошью, смоченной в растворе дезсредства.
Дезинфекция поверхностей помещения
Помещение лаборатории должно содержаться сотрудниками в чистоте. Так, минимум дважды в день в помещении должна проводиться влажная уборка с дезсредствами. Текущая уборка подразумевает мытье полов, стен, поверхностей мебели и оборудования, сантехники.
Каждый месяц в лаборатории медперсонал проводит генеральную уборку с дезсредствами. Во время генуборки моют все поверхности помещения (пол, стены, потолок), а также объекты, находящиеся в нем (всю мебель и оборудование). Такие мероприятия существенно снижают риски заражения медперсонала опасными инфекциями.
Вернуться к списку публикаций
ДЕЗИНФЕКЦИЯ ЛАБОРАТОРНОГО ИНСТРУМЕНТАРИЯ, ПОСУДЫ, СПЕЦОДЕЖДЫ, БИОМАТЕРИАЛА, ОБОРУДОВАНИЯ
⇐ ПредыдущаяСтр 2 из 3
Лабораторные инструменты, иглы, капилляры, предметные стекла, пробирки, меланжеры, счетные камеры, кюветы фотоэлектрометра, пипетки, наконечники, резиновые груши, баллоны и т.д., посуда после каждого использования должны подвергаться дезинфекции.
Использованные изделия промываются в ёмкости с водой. Промывные воды обеззараживаются кипячением в течение 30 минут или засыпают сухой хлорной известью, известью белильной термостойкой, нейтральным гипохлоритом кальция (НГК) в соотношении 200 г на 1 л воды, перемешивают и обеззараживают в течение 60 минут. Промытые изделия кипят в закрытой емкости в воде в течение 30 минут, или в 2% растворе соды, дальнейшая предстерилизационная очистка не проводится.
Лабораторные инструменты могут быть обеззаражены погружением в раствор с дезинфицирующим раствором.
Основные характеристики различных групп дезинфицирующих средств

Время обеззараживания – см. инструкцию.
Дезинфицирующие растворы используются однократно.
Емкости для проведения дезинфекции должны быть чётко маркированы, иметь крышки.
При дезинфекции изделий, имеющих внутренние каналы, растворы дезинфицирующего средства в объёме 5-10 мл пропускают через канал с помощью груши для удаления остатков крови, сыворотки и др., после чего изделия полностью погружают в дезинфицирующий раствор во вторую ёмкость.
При погружении инструментов в горизонтальном положении полости каждого инструмента должны быть заполнены дезинфицирующим раствором.
Каждая партия сухих хлорсодержащих дезинфектантов перед использованием должна подвергаться контролю на содержание активного хлора.
Посуда, соприкасающаяся с кровью или сывороткой и не предназначенная для последующего контакта с обследуемым после дезинфекции промывается под проточной водой для полного удаления дезинфектанта и проходит необходимую технологическую обработку.
Ёмкости кювет-анализатора ФП, кюветы измерительной аппаратуры, пластиковые пробирки и т.д. обеззараживаются только 6% раствором перекиси водорода и промываются проточной водой.
С предметных стёкол с фиксированным и окрашенным мазком крови после проведения микроскопии удаляются остатки иммерсионного масла, стёкла кипятятся в мыльном растворе не менее 15 минут до полного отхождения краски, затем промываются под проточной водой, подсушиваются на воздухе и протираются.
Остатки крови, мочи, спинномозговой жидкости и т.п., пробы, содержащие разведенную сыворотку без добавления кислот, щелочей сливают в специальную тару и обеззараживают сухой хлорной известью, известью белильной термостойкой, нейтральным гипохлоритом кальция в соотношении 1:5 в течение часа. При удалении сгустков следует предварительно отделить материал металлическим шпателем, который затем обеззараживается. Посуда из-под мочи, кала обрабатывается по описанной выше методике, но может не подвергаться стерилизации.
При загрязнении кровью или секретами мебели, инвентаря, приборов их следует немедленно дважды протереть ветошью, ватными или марлевыми тампонами, обильно смоченными дезинфицирующими растворами.
Использованную ветошь сбрасывают в специально выделенную ёмкость с дезраствором, маркированную: «Для дезинфекции использованной ветоши».
При загрязнении кровью или секретами спец. одежды, её снимают, предварительно обработав дезраствором участок загрязнения.
Для санитарной обработки помещений КДЛ можно применять только те дезинфицирующие средства, которые официально разрешены Департаментом госсанэпиднадзора Минздрава России, зарегистрированы в Бюро по регистрации лекарственных средств и имеют свидетельство о государственной регистрации, сертификат соответствия и методические указания по применению, утвержденные Департаментом госсанэпиднадзора Минздрава России.
Средства для дезинфекции поверхностей в помещениях КДЛ должны соответствовать следующим требованиям:
1. Обеспечивать гибель возбудителей внутрибольничных инфекций: бактерий, вирусов, грибов — при комнатной температуре;
2. Обладать моющими свойствами или хорошо совмещаться с моющими средствами;
3. Иметь относительно низкую токсичность (4-3 класс опасности) и быть безвредными для окружающей среды;
4. Быть совместимыми с различными видами материалов (не портить обрабатываемые поверхности);
5. Быть стабильными, неогнеопасными, простыми в обращении;
6. Не оказывать фиксирующего действия на органические загрязнения.
В настоящее время в России разрешены к применению 242 средства дезинфекции из различных химических групп, отличающиеся физико-химическими свойствами (форма применения, растворимость, стабильность, наличие моющего действия, значение рН растворов и т.д.), специфической биологической (антимикробной) активностью, токсичностью, назначением, сферой применения. Для достижения противоэпидемического эффекта дезинфекционного мероприятия необходимо правильно выбрать дезинфицирующее средство, соответствующее поставленной задаче. Для этого медицинский персонал должен хорошо знать основные свойства и особенности конкретных дезинфицирующих средств.
Анализ свойств современных дезинфицирующих средств, проведенный в соответствии с перечисленными критериями, показал, что для проведения дезинфекции поверхностей в помещениях КДЛ пригодны, в первую очередь, средства, относящиеся к группе катионных ПАВ (четвертичные аммониевые соединения, третичные амины, производные гуанидинов) и композиции на их основе. Приемлемо применение хлорактивных и кислородактивных средств при наличии у них моющих свойств или при возможности добавления к ним моющих средств непосредственно перед их использованием. Дезинфицирующие средства из других химических групп по тем или иным причинам для обработки поверхностей в помещениях менее пригодны.
Порядок проведения санитарной обработки поверхностей в помещениях (пол, стены, двери и др., жесткая мебель, поверхности аппаратов, приборов, оборудования и т.д.), необходимость использования моющих или дезинфицирующих средств, частота проведения обработок зависят от профиля КДЛ и функционального назначения конкретного помещения.
В помещениях КДЛ любого профиля, в соответствии с действующими нормативными документами, два раза в сутки проводится влажная уборка с применением моющих или моюще-дезинфицирующих средств.
Генеральная уборка диагностических лабораториях проводится 1 раз в неделю, в ванных комнатах, туалетах, подсобных и вспомогательных помещениях — 1 раз в 10-15 дней.
Прежде, чем приступить к работе, медицинский персонал, проводящий обработку, должен внимательно изучить методические указания по применению выбранного конкретного средства, обращая внимание на спектр антимикробного действия (обеспечит ли средство гибель имеющегося на поверхностях микроорганизма), параметры токсичности (можно ли применять средство в присутствии больных, какие использовать меры предосторожности при работе с ним и т.д.), обладает ли средство моющим действием, а также имеющиеся характерные особенности средства.
Растворы дезинфицирующих средств готовят в специальном помещении, оборудованном приточно-вытяжной вентиляцией или в вытяжном шкафу. Персонал, готовящий раствор, должен работать в спецодежде: халат, шапочка, марлевая повязка, резиновые перчатки, а если есть указания, то и респиратор определенной марки и защитные очки.
Растворы дезинфицирующих средств готовят путем смешивания дезинфицирующего средства с водопроводной водой в специальной технической посуде (емкости). Если средство обладает коррозионной активностью (хлорактивные, кислородактивные средства), для рабочих растворов используют емкости из коррозионностойкого материала (пластик, стекло, эмаль без повреждения). Более удобны для применения градуированные емкости, позволяющие дозировать смешиваемые ингредиенты. Необходимое для приготовления рабочего раствора количество дезинфицирующего средства в виде порошка взвешивают на весах или пользуются специальными мерными ложками, которые прилагаются к упаковке средства. Дезинфицирующие средства в виде водных или спиртовых концентратов для приготовления раствора отмеряют с помощью мерного градуированного стакана, пипетки или шприца. Иногда дезинфицирующие средства выпускаются во флаконах с вмонтированной в них или съемной (в виде второй крышки-колпачка) мерной емкостью или в емкостях с насосом.
Для получения нужной концентрации при приготовлении рабочего раствора важно соблюдать рекомендованное соотношение средства и воды (см. Методические указания по применению конкретного средства). Обычно при приготовлении рабочего раствора сначала в емкость наливают требуемое количество воды, затем добавляют к ней дезинфицирующее средство, размешивают и закрывают крышкой до полного растворения. Наиболее удобно готовить рабочие растворы дезинфицирующих средств, производимых в форме таблеток или в разовых упаковках.
В зависимости от химической природы рабочие растворы некоторых средств могут быть приготовлены впрок и храниться в закрытой емкости в специальном помещении до применения определенное время (сутки и более), другие должны быть использованы сразу после приготовления.
Поверхности в помещениях (пол, стены, двери и т.д.), жесткую мебель, поверхности аппаратов, приборов обеззараживают способом протирания ветошью, смоченной в растворе дезинфицирующего средства или способом орошения.
Для обработки поверхностей в помещениях КДЛ более приемлем способ протирания, позволяющий сочетать процесс дезинфекции с мытьем объекта. Для этих целей целесообразно использовать средства, обладающие наряду с антимикробными также моющими свойствами. Для дезинфекции небольших, трудно доступных поверхностей, а также для экстренной обработки небольших по площади поверхностей применяют дезинфицирующие средства способом распыления с помощью ручного распылителя типа «Росинка» или средства в аэрозольной упаковке. При необходимости проведения заключительной дезинфекции в КДЛ, при перепрофилировании кабинета, иногда при проведении генеральных уборок поверхности обрабатывают способом орошения из гидропульта или другого распыляющего устройства, позволяющего обработать помещение большого объема. При использовании для дезинфекции способа орошения медицинский персонал должен строго соблюдать все рекомендуемые меры предосторожности: защитную одежду, респиратор, защитные очки, резиновые перчатки. Такую обработку следует проводить в отсутствие больных.
Воздух и дополнительно поверхности в помещениях КДЛ обеззараживают ультрафиолетовым облучением с помощью бактерицидных облучателей, которые по месту расположения могут быть потолочными, настенными и передвижными, а по конструкции — открытого (применяют в отсутствие больных), закрытого (возможно применение в присутствии людей) и комбинированного типа. Разновидностью закрытого облучателя являются рециркуляторы воздуха с естественным или принудительным прохождением потока воздуха через камеру, внутри которой расположены бактерицидные облучатели, рекомендованные для непрерывного режима облучения в помещениях с постоянным пребыванием людей и высокими требованиями асептики. Режим дезинфекции зависит от мощности облучателя, объема помещения, критериев эффективности его обеззараживания, связанных с его функциональным назначением и определяется в соответствии с «Методическими указаниями по применению бактерицидных ламп для обеззараживания воздуха и поверхностей» №11-16/03-06, утвержденными Минздравмедпромом РФ 28.02.95 г.
Санитарно-техническое оборудование протирают ветошью или чистят щетками (ершами), смоченными в дезинфицирующем растворе или используют чистяще-дезинфицирующие средства в виде порошка, пасты, геля или другой готовой формы, рекомендованные для этих целей и обладающие наряду с дезинфицирующими свойствами хорошими потребительскими качествами (моющими, отбеливающими, чистящими, дезодорирующими). Чаще всего это хлорактивные или кислородсодержащие средства.
Уборочный инвентарь: ветошь, салфетки, губки, мочалки и т.д. — после уборки помещения и обработки объектов замачивают в дезинфицирующем растворе, по истечении экспозиции стирают или моют, прополаскивают водопроводной водой, высушивают и хранят в определенном месте. Использованные ветошь, салфетки и т.д. можно продезинфицировать также способом кипячения. Емкости, из которых производилась обработка помещений, освобождают от использованного дезинфицирующего раствора, моют и высушивают. Ерши, щетки замачивают в дезинфицирующем растворе на определенный срок, после чего споласкивают водопроводной водой. Все средства для уборки помещений должны находиться в отдельной комнате, каждое на своем, для него отведенном месте, и быть промаркированы в соответствии с тем, для обработки какого объекта и какого помещения они предназначены. Для каждого помещения и для отдельных объектов должен быть отдельный уборочный инвентарь.
Генеральные уборки в КДЛ проводятся в соответствии с планом-графиком. В каждом подразделении должно быть определенное количество наборов уборочного инвентаря, в зависимости от числа помещений, в которых должна проводиться уборка. Генеральную уборку проводят в отсутствие больных при открытых фрамугах. Сначала из помещения удаляют мусор и медицинские отходы, собранные в контейнеры. Мебель отодвигают от стен. Тщательно моют стены, двери и т.д., уделяя особое внимание выключателям, дверным ручкам, замкам. Ветошью, смоченной в дезинфицирующем растворе, протирают светильники, арматуру, отопительные батареи, мебель, поверхности аппаратов, приборов, освобождая их от пыли. Один раз в месяц моют изнутри окна (снаружи окна моют 1 раз в полгода). Заканчивают уборку мытьем пола, начиная из дальнего конца комнаты, тщательно вымывая углы, плинтуса и пол около них по всему периметру комнаты, затем моют ее центральную часть. В помещениях, требующих особо строгого соблюдения правил асептики после влажной уборки включают ультрафиолетовые облучатели (время облучения устанавливается в зависимости от различных факторов в соответствии с действующими методическими указаниями — см. выше). Если поверхности в помещениях обрабатывали способом орошения, по истечении дезинфекционной выдержки проводится влажная уборка.
При санитарной обработке КДЛ возможно также использование препаратов для обеззараживания воздуха. Таких как:
Триэтиленгликоль. Аэрозоль получают путем испарения триэтиленгликоля с металлических лотков (размер 20-15 см) при слабом подогреве (с помощью электрической плитки или горелки, помещенных под лотком на расстоянии 20-30 см). Испарение производят в течение 20-40 минут, за сутки до помещения больного в палату. Расход дезинфицирующего вещества 0,1 г на 1 куб.м воздуха.
Концентрированная пищевая молочная кислота. Испарение молочной кислоты производят в течение 20 минут, из расчета 0,01-0,015 мл на 1 куб.м воздуха с поверхности кружочка фильтровальной бумаги, положенного на кольцо
бунзеновского штатива над электрической плиткой на расстоянии 20 см (молочная кислота наносится на фильтровальную бумагу пипеткой).
Раствор перекиси водорода в 0,5% молочной кислоте. Распыление производят в течение 40-50 минут с помощью специальных аэрозольных генераторов или пульверизаторов, пылесоса со специальной насадкой (величина отверстия 0,3-0,5 мм). Расход дезинфицирующего раствора 5 мл на 1 куб.м воздуха.
Примечание: Обеззараживание воздуха палат раствором 3% перекиси водорода с 0,5% молочной кислотой можно проводить как накануне до помещения больного в палату, так и за 2 часа.
Распыление аэрозольного баллона «Букет» производят при расходе аэрозольной смеси 5 г на 1 куб. м воздуха.
Стирка спецодежды на дому категорически запрещается. Смена спецодежды должна осуществляться не менее 2 раз в неделю.
Перчатки после окончания работы обеззараживаются погружением в 3% раствор хлорамина или 6% раствор перекиси водорода на 1 час или кипячением в течение 30 минут.
Одноразовый инструментарий (плашки, наконечники автоматических пипеток и т.д.) обеззараживаются и утилизируются в паровом стерилизаторе при 2,0 кг/см2 (1320С) – 60 минут.
⇐ Предыдущая123
Стерилизация лабораторной посуды.
Стерилизация – обеспложивание; уничтожение в каком-либо материале патогенных и непатогенных микроорганизмов в вегетативной и споровой формах.
Подготовка посуды для стерилизации. Лабораторная посуда должна быть чисто вымытой и простерилизованной. Для мытья используют растворы мыла или химические моющие средства. Новую посуду предварительно кипятят в 1-2%-м растворе соляной кислоты, во избежание последующего выщелачивания стекла. Вымытую в проточной воде посуду ополаскивают дистиллированной водой и высушивают.
Бактериологические пробирки. Конические, матровые колбы закрывают ватно-марлевыми пробками, состоящими из плотно скрученных валиков ваты, покрытых слоем марли. Для бактериологических пробирок также разработаны металлические пробки в виде наружных колпачков. Следует учитывать, что стерилизация ватных пробок при высокой температуре приводит к выделению из ваты веществ, ингибирующих рост некоторых чувствительных бактерий, например бруцелл.
При монтаже пипеток в верхний конец вставляют ватный тампон. У пипеток Пастера должен быть запаян капилляр. Каждую мерную пипетку заворачивают длинной полоской бумаги шириной 4-5 см, начиная с носика, винтообразно по всей длине. Пипетки Пастера заворачивают в бумагу по 10-20 штук, пробирки – по 15-20 штук. Все виды пипеток лучше хранить до и после стерилизации в специальных металлических пеналах. Пробки на колбах дополнительно покрывают колпачками из бумаги.
Чистые чашки Петри в собранном виде перед стерилизацией заворачивают в бумагу по 3-4 штуки. После стерилизации бумага предохраняет стерильную посуду от загрязнения микрофлорой.
Посуду перед стерилизацией размещают в сушильном шкафу не слишком плотно, чтобы обеспечить циркуляцию воздуха, и следят, чтобы температура не превышала 180˚С, так как при более высокой температуре бумага и вата будут обугливаться. После окончания стерилизации сушильный шкаф не открывают до тех пор. Пока температура в нем не снизится до 70-80˚С, поскольку резкий перепад температур может привести к разрушению стекла.
Если посуда предназначена для стерилизации в ней питательных сред автоклавированием под давлением не менее 1 атм, то ее предварительно не стерилизуют. При стерилизации сред текучим паром или в автоклаве под давлением не более 0,5 атм необходимо использовать стерильную посуду.
Стерилизация сухим нагретым воздухом. Метод применяют для стерилизации чистой стеклянной посуды. Для этого используют печь Пастера – специальный сушильный шкаф с двойными стенками. Снаружи он облицован теплонепроницаемым материалом. В верхней его части находится термометр. Между теплонепроницаемой обшивкой и внутренним металлическим корпусом на дне помещен автоматический электронагревательный элемент. При включении сушильного шкафа в электросеть воздух внутри него нагревается. По достижении заданной температуры отмечают время начала стерилизации. Режим стерилизации: при температуре 155-160˚С – экспозиция 2 ч, при 165-170˚С – 1-1,5 ч, при 180˚С – 1 ч. По истечении времени стерилизации нагревание прекращают.
Автоклавирование. Это стерилизация паром под давлением в сочетании с высокой температурой в специальном аппарате – автоклаве. При встрече насыщенного пара с более холодным объектом пар конденсируется, превращаясь в воду, в результате чего выделяется большое количество тепла. Кроме того, уменьшается объем пара, что способствует его проникновению во внутренние части стерилизуемого материала. Обязательное условие – поступление действительно насыщенного пара, чтобы его соприкосновение с холодным предметом вело к немедленной конденсации и нагреванию. Промышленность выпускает вертикальные и горизонтальные автоклавы.
Вертикальный автоклав – это двустенный металлический котел цилиндрической формы, закрываемый герметично крышкой. Между стенками через специальный кран с воронкой заливают воду до определенного уровня. Внутренняя стенка котла в верхней части снабжена отверстиями, в нижней – краном, через который при нагревании воды пар вытесняет воздух из котла. Сверху на автоклав надевают металлический защитный каркас, причем между ним и самим автоклавом должно быть свободное пространство. Автоклав нагревают включением в электросеть.
Автоклав загружают стерилизуемым материалом, закрывают крышку и кран, через который заливали воду, нижний кран временно отваляют открытым. Нагреваемая вода между стенками автоклава кипит, образующийся пар поднимается вверх и через верхние отверстия внутренней стенки проходит внутрь котла, толчками вытесняя воздух через нижний открытый кран. Когда воздух весь вытеснен, и пар начинает выходить ровной струей, нижний кран закрывают. В результате давление пара внутри автоклава повышается. Началом стерилизации считают момент, когда давление достигает заданной величины (по показателям манометра). Нагрев регулируют на протяжении всей стерилизации, поддерживая давление пара на одном уровне. При чрезмерном повышении давления внутри автоклава предусмотрен предохранительный клапан, через который избыток пара автоматически выходит наружу.
При повышении давления пара соответственно повышается и температура в автоклаве.
Манометр показывает давление пара без учета окружающего атмосферного давления (760 мм рт. ст.). По истечении времени стерилизации автоклав отключают. После остывания при нулевом показании манометра открывают кран для спуска пара.
Горизонтальный автоклав отличается от вертикального конструкцией, но принцип действия у него такой же.
Стерилизация — это уничтожение в материалах, продуктах, жидкостях, на поверхностях посуды и оборудования всех видов микроорганизмов и их спор. Мы уже рассказывали о таком способе стерилизации, как автоклавирование, упоминали другие способы стерилизации. Сегодня расскажем о самых популярных из них подробнее.
Стерилизация сухим теплом
Часто применяется в лабораторной практике. Для этого используются суховоздушные термостаты или сушильные шкафы. Высокие температуры гораздо эффективнее убивают живые клетки микроорганизмов, чем низкие температуры. Многие бактерии способны пережить обработку даже жидким кислородом при температуре -252 °С.
Обработка сухим теплом менее эффективна, чем влажным. Для полного уничтожения микроорганизмов в условиях влажного тепла нужно выдержать материал около 30 минут при +110-130 °С, а в суховоздушном шкафу — 45 минут при +180 °С.
Сухим теплом стерилизуют лабораторную стеклянную посуду (колбы, пипетки, пробирки, чашки Петри и пр.) при +160-200 °С. Чем ниже температура, тем дольше длится стерилизация: от 2 часов при +160 °С до 15 минут при +200 °С.
Стерилизация влажным теплом
Процедуру проводят в аппаратах Коха, похожих на бытовую пароварку. Вода кипит в нижнем отделении и пар стерилизует материалы, помещенные в верхнее отделение. Такой стерилизации обычно подвергают микробиологические среды, которые нельзя нагревать выше +100 °С.
Часто применяют дробную стерилизацию: выдерживают обрабатываемый раствор в течение часа при температуре около +70 °С, потом снижают температуру до оптимального для микроорганизмов уровня на сутки и опять нагревают, уничтожая все проросшие клетки. Так повторяют три-четыре раза.
Кипячение
Кипячением стерилизуют медицинские металлические инструменты, шприцы, резиновые перчатки, пинцеты, резиновые груши и т.п. Время процедуры отсчитывают от того момента, когда закипела вода.
Металлические инструменты кипятят в слабом (двухпроцентном) растворе гидрокарбоната натрия, который не оказывает на металл коррозионного действия.
Облучение
Уничтожать микроорганизмы можно рентгеновским, альфа-, бета- и гамма, нейтронным, УФ-излучением. Обычно этот метод применяется на производствах. В лабораториях и медицинских учреждениях часто применяют бактерицидные лампы и установки типа «Амбилайф» для очистки воздуха и поверхностей в помещении.
Пастеризация
Применяется для обработки продуктов питания и некоторых лабораторных образцов. Она подразумевает уничтожение многих живых микроорганизмов, грибковых спор при температуре не более 80 °С, в течение 10 минут или менее. При этом вкусовые качества продуктов не изменяются. Кроме этого, сохраняются некоторые виды полезных бактерий.
Прокаливание в пламени
Этим методом стерилизуют микробиологические петли и иглы, концы пинцетов, сверла для пробок и т. п., иногда стеклянные принадлежности. Прокаливание производится в пламени газовой горелки. Более технологичный способ — прокаливание при температуре до +850 °С в электрическом стерилизаторе. В этом случае удается избежать загрязнения инструментов продуктами горения пламени.
Фильтрование
Для стерилизации питательных сред или жидкостей, разрушающихся при нагревании, используется фильтрование под вакуумом через специализированные фильтры. Фильтры подбирают таким образом, чтобы диаметр отверстий был меньше размера бактерий. Применяются фильтры фарфоровые, стеклянные, из глинозема, асбестовые, мембранные и др. Для того, чтобы оптимизировать процесс фильтрации, выпускаются специальные приборы со встроенным вакуумным насосом, например, система вакуумной фильтрации Lafil 400-LF 30.
Химическая стерилизация
Для химической дезинфекции применяются самые разнообразные вещества:
- этиловый и изопропиловый спирты;
- соединения хлора (гипохлорит натрия, хлорамины) и йода;
- соединения тяжелых металлов, например, ртути, серебра;
- производные фенола;
- микробоцидные (убивающие микробы) газы, к которым относят пары формальдегида, пропиолактона, оксид этилена.
Химическая стерилизация используется в лабораториях для оперативной обработки, а также в тех случаях, когда невозможно использовать другие методы.
>Инструкция по мерам профилактики распространения инфекционных заболеваний при работе в клинико-диагностических лабораториях лечебно-профилактических учреждений
Инструкция по мерам профилактики распространения инфекционных заболеваний при работе в клинико-диагностических лабораториях лечебно-профилактических учреждений
УТВЕРЖДЕНА
Минздравом СССР
17 января 1991 года
Общие положения
С целью профилактики инфицирования медицинского персонала лечебно-профилактических учреждений особое значение имеет выполнение требований противоэпидемического режима.
Ответственность за организацию и соблюдение противоэпидемического режима при работе с потенциально опасным материалом возлагается на руководителя клинико-диагностической лаборатории (КДЛ).
Инструктаж среднего и младшего медицинского персонала проводится ответственным за технику безопасности не реже одного раза в квартал.
Инструкция составлена в соответствии с ГОСТом 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы», а также приказом Минздрава СССР (1989 год) «О мерах по снижению заболеваемости вирусным гепатитом в стране».
I. Основные правила работы в КДЛ
Медицинскому персоналу КДЛ следует избегать контактов кожи и слизистых оболочек с кровью и другими биологическими жидкостями, для чего необходимо:
1. Работать в медицинских халатах, шапочках, сменной обуви, а при угрозе забрызгивания кровью или другими биологическими жидкостями — в масках, очках, клеенчатом фартуке.
2. Работать с исследуемым материалом в резиновых перчатках, все повреждения кожи на руках должны быть закрыты лейкопластырем или напальчником. Избегать уколов и порезов.
3. Проводить разборку, мойку, прополаскивание лабораторного инструментария, посуды после предварительной дезинфекции в резиновых перчатках.
4. В случае загрязнения кожных покровов кровью или другими биологическими жидкостями следует немедленно обработать их в течение 2 мин тампоном, обильно смоченным 70% спиртом, вымыть под проточной водой с мылом и вытереть индивидуальным тампоном. При загрязнении перчаток кровью их протирают тампоном, смоченным 3% раствором хлорамина, 6% раствором перекиси водорода.
При подозрении на попадание крови на слизистые оболочки их немедленно обрабатывают струей воды, 1% раствором протаргола; рот и горло прополаскивают 70% спиртом, или 1% раствором борной кислоты, или 0,05% раствором перманганата калия.
5. Запрещается есть, пить, курить и пользоваться косметикой на рабочем месте.
6. Запрещается пипетирование крови ртом; следует использовать автоматические пипетки, а при их отсутствии — резиновые груши.
7. Поверхность рабочих столов в конце каждого рабочего дня подвергается дезинфекции, а в случае загрязнения биологическим материалом — немедленно.
II.Способы взятия крови
Взятие крови следует проводить в резиновых перчатках, соблюдая правила асептики, обрабатывая перчатки 70% спиртом перед каждым взятием. Перед проколом кожу пальца обследуемого обрабатывают стерильным тампоном (шариком из ваты), смоченным 70% спиртом.
После взятия крови к раневой поверхности прикладывают новый стерильный тампон, смоченный 70% спиртом. Извлекать скарификаторы следует только с помощью пинцета, хранящегося в растворе дезинфекционного средства.
Стерильные тампоны хранятся в упаковке из бумаги, указанной в ГОСТе 42-21-2-85, в количестве не более 20 штук. Стерильные лабораторные инструменты хранятся в той же упаковке, в которой проводилась их стерилизация. Существует несколько вариантов взятия крови для гематологического исследования.
I вариант. После прокола пальца несколько капель крови (не менее 3-4), спускают на индивидуальное предметное (часовое) стекло, перемешивают и используют для работы.
II вариант. Кровь набирают в индивидуальные стерильные, предварительно выверенные капилляры объемом 20 мкл и капилляры Панченко непосредственно с поверхности кожи проколотого индивидуальным копьем пальца пациента.
III вариант. Кровь в количестве 40 мкл набирают стерильным индивидуальным капилляром Панченко, предварительно смоченным цитратом в соотношении цитрата и крови 1: 4 по объему.
IV вариант. После прокола кожи пальца 6-8 капель крови спускают в пластиковую пробирку, в которую предварительно внесено небольшое (на кончике глазной лопаточки) количество трилона Б.
Пробирку с кровью тщательно перемешивают, вращая ее между ладонями. Разлив крови пипетками по пробиркам осуществляется в лаборатории.
Таблица N 1. Приготовление моющего раствора
Таблица N 1
|
Компонент |
Количество компонентов для приготовления 1 л моющего р-ра |
Применение |
|
Моющее средство «Биолот», г |
При механизированной очистке (струйный метод) |
|
|
Вода питьевая, мл |
997,0 |
|
|
Моющее средство «Биолот», г |
||
|
Вода питьевая, мл |
995,0 |
При ручной очистке |
|
Раствор перекиси водорода: |
При механизированной очистке (струйный метод, использование ультразвука) и ручной очистке |
|
|
27,5% |
17(978) |
|
|
30,0% |
16(979) |
|
|
33,0% |
||
|
3,0% |
160(835) |
|
|
Моющее средство «Прогресс», «Айна», «Астра», «Лотос», «Лотос-автомат», «Маричка», г |
При механизированной очистке с использованием ультразвука |
|
|
Вода питьевая, мл (см3) |
995,0 |
Примечание. При использовании моющего средства, содержащего 0,5% перекиси водорода и 0,5% синтетического моющего средства «Лотос» и «Лотос-автомат», применяют ингибитор коррозии — 0,14% олеат натрия (1,4 г на 1 л раствора). В скобках указано количество питьевой воды в мл.
Таблица N 2. Предстерилизационная очистка (ручной способ)
Таблица N 2
|
Режим очистки |
|||||
|
Процесс при проведении очистки |
Температура, С° |
Время выдержки, мин |
Применяемое оборудование |
||
|
Номинальное значение |
Предельное отклонение |
Номинальное значение |
Предельное отклонение |
||
|
Замачивание в моющем растворе при полном погружении изделия при применении моющего средства «Биолот» |
+5 |
15,0 |
1,0 |
Бачок, ванна, раковина |
|
|
То же при применении моющего средства «Прогресс», «Астра», «Лотос», «Лотос-автомат», «Айна», «Маричка» |
+5 |
15,0 |
+1,0 |
То же |
|
|
Мойка каждого изделия в моющем растворе при помощи ерша и ватно-марлевого тампона |
0,5 |
+0,1 |
|||
|
Ополаскивание проточной водой: |
|||||
|
— при применении моющего средства «Биолот» |
3,0 |
Ванна, раковина с устройством для струйной подачи |
|||
|
— при применении моющего средства «Маричка», «Прогресс» |
5,0 |
+1,0 |
|||
|
— при применении средств «Астра», Лотос», «Айна», «Лотос-автомат» |
10,0 |
||||
|
Ополаскивание дистиллированной водой |
0,5 |
+0,1 |
Бак, ванна |
||
|
Сушка горячим воздухом |
+2 |
До полного исчезновения влаги |
Сушильный шкаф |
||
Примечания:
1. Температура раствора в процессе мойки не поддерживается.
2. Моющий раствор перекиси водорода с синтетическими моющими средствами, в том числе «Лотос», «Лотос-автомат», с ингибитором коррозии можно использовать в течение суток с момента изготовления, если цвет раствора не изменился. Неизмененный раствор можно подогревать до 6 раз, в процессе подогрева концентрация перекиси водорода существенно не изменяется.
3. Раствор моющего средства «Биолот», применяемый как при ручном, так и при механическом способе, используется однократно, так как при повторном использовании фермент, входящий в состав моющего средства, разрушается в процессе очистки.
III. Дезинфекция лабораторного инструментария, посуды, спецодежды, биоматериала, оборудования
Лабораторные инструменты, иглы, капилляры, предметные стекла, пробирки, меланжеры, счетные камеры, кюветы фотоэлектроколориметра, пипетки, наконечники, резиновые груши, баллоны и т.д., посуда после каждого использования должны подвергаться дезинфекции.
1. Использованные изделия промывают в емкости с водой. Промывные воды обеззараживают кипячением в течение 30 мин или засыпают сухой хлорной известью, известью белильной термостойкой, нейтральным гипохлоритом кальция (НГК) в соотношении 200 г на 1 л, перемешивают и обеззараживают в течение 60 мин. Промытые изделия кипятят в закрытой емкости в воде в течение 30 мин или в 2% растворе соды в течение 15 мин. (В случае кипячения изделий в 2% растворе соды дальнейшая предстерилизационная очистка не проводится.)
2. Лабораторные инструменты могут быть обеззаражены погружением в раствор с дезинфицирующим раствором.
В качестве дезинфицирующих используются следующие растворы: 3% раствор хлорамин, 6% перекись водорода, 6% перекись водорода с 0,5% моющего средства («Прогресс», «Астра». «Айна», «Лотос», «Лотос-автомат»), 4% формалин, 0,5% НГК, 0,5% сульфохлорантин; время обеззараживания 60 мин.
Дезинфицирующие растворы используются однократно.
Емкости для проведения дезинфекции должны быть четко маркированы, иметь крышки.
При дезинфекции изделий, имеющих внутренние каналы, растворы дезинфекционного средства в объеме 5-10 мл пропускают через канал с помощью груши для удаления остатков крови, сыворотки и пр., после чего изделия полностью погружают в дезинфицирующий раствор во вторую емкость.
При погружении инструментов в горизонтальном положении полости каждого инструмента должны быть заполнены дезинфицирующим раствором.
3. Каждая партия сухих хлорсодержащих дезинфектантов перед использованием должна подвергаться контролю на содержание активного хлора.
4. Посуду, соприкасающуюся с кровью или сывороткой и не предназначенную для последующего контакта с обследуемым, после дезинфекции промывают проточной водой для полного удаления дезинфектанта и проводят необходимую технологическую обработку.
5. Блоки кювет анализатора ФП, кюветы измерительной аппаратуры, пластиковые пробирки и т.д. обеззараживают только 6% раствором перекиси водорода и промывают проточной водой.
6. С предметных стекол с фиксированным и окрашенным мазком крови после проведения микроскопии удаляют остатки иммерсионного масла, стекла кипятят в мыльном растворе не менее 15 мин до полного отхождения краски, затем промывают проточной водой, подсушивают на воздухе и протирают.
7. Остатки крови, мочи, спинномозговой жидкости и т.д., пробы, содержащие разведенную сыворотку без добавления кислот, щелочей сливают в специальную тару и обеззараживают сухой хлорной известью, известью белильной термостойкой, НГК в соотношении 1:5 в течение 1 часа. При удалении сгустков следует предварительно отделить материал металлическим шпателем, который затем обеззараживают. Посуду из-под мочи, кала обрабатывают по описанной выше методике, но ее можно не подвергать стерилизации.
8. При загрязнении кровью или секретами мебели, инвентаря, приборов их следует немедленно дважды протереть ветошью, ватными или марлевыми тампонами, обильно смоченными дезинфицирующими растворами.
Использованную ветошь сбрасывают в специально выделенную емкость с дезинфицирующим раствором, маркированную «Для дезинфекции использованной ветоши».
9. При загрязнении кровью или секретами спецодежды ее снимают, предварительно обработав дезинфицирующим раствором участок загрязнения.
Стирка спецодежды на дому категорически запрещается. Смена спецодежды должна осуществляться не менее 2 раз в неделю.
10. Перчатки после окончания работы обеззараживают погружением в 3% раствор хлорамина или 6% раствор перекиси водорода на 1 час или кипячением в течение 30 мин.
11. Одноразовый инструментарий (плашки, наконечники, автоматические пипетки и т.д.) обеззараживают и утилизируют в паровом стерилизаторе при 2,0 кг/2 (132° С) в течение 60 мин.
IV. Предстерилизационная очистка
После дезинфекции лабораторный инструментарий, соприкасающийся с раневой поверхностью или слизистыми оболочками обследуемого, подлежит обязательной предстерилизационной очистке и стерилизации.
Предстерилизационную очистку проводят с применением моющих растворов (табл.1 и 2).
Количество предстерилизационной очистки изделий оценивают на наличие крови путем постановки бензидиновой или амидопириновой пробы, на наличие остаточных количеств щелочных компонентов моющего вещества — путем фенолфталеиновой пробы.
Самоконтроль в КДЛ проводят ежедневно, контролю подвергают не менее 1% от одновременно обработанных изделий одного наименования, но не менее 3-5 единиц.
При положительной пробе на кровь или моющее средство всю группу контролируемых изделий подвергают повторной обработке до получения отрицательных результатов.
После дезинфекции и предстерилизационной очистки проводят стерилизацию игл, шприцев, пробирок, пипеток, стеклянных палочек, стекол, меланжеров и т.д.
V. Режимы и условия стерилизации указаны в таблицах 3-5
Таблица N 3. Режим и условия стерилизация воздушным методом
Таблица N 3
|
Режим стерилизации |
|||||||
|
Рабочая температура в стерилиз. камере, С° |
Время выдержки, мин |
Применя- |
Условия проведения стерилизации |
Срок сохранения стерильности |
Применя- |
||
|
Номина- |
Преде- |
Номина- |
Преде- |
||||
|
от +2 |
+5 |
Для изделий из металла, стекла, силико- |
Стерилизации подвергают сухие изделия. Стерилизацию проводят в упаковке из бумаги мешочной непропитанной и бумаги непропитанной и влагопрочной, бумаги для упаковки продуктов на автоматах марки Е, бумаги упаковочной высокопрочной, бумаги двухслойной крепированной или без упаковки в открытых емкостях |
Изделия, простерилизо- |
Воздушный стерили- |
||
Примечания:
1. Капилляры, микропипетки, иглы-копья, предметные стекла помещают в бумажную упаковку в количестве не более 5-10 штук. Бумажная упаковка может быть использована не более 5 раз.
2. Иглы-копья можно стерилизовать в конических пробирках в количестве 5-10 штук. Копья укладывают острием вниз, пробирку закрывают сверху упаковочной бумагой.
3. Эффективность воздушной стерилизации зависит от равномерного распределения горячего воздуха в стерилизационной камере. При стерилизации изделий в воздушных стерилизаторах, не имеющих принудительной вентиляции (СС-200, СС-200М, ШСС-80), плотность загрузки не должна превышать 50% площади полок.
4. Стерилизуемые изделия необходимо укладывать горизонтально поперек пазов кассет, полок.
5. Загрузка стерилизатора навалом запрещена.
6. Режим работы стерилизатора контролируется ежедневно одним из химических индикаторов (винная кислота, гидрохинон, тиомочевина), индикаторы размещают на каждой полке в 5 точках: 1 — в центре, остальные — слева и справа у двери и задней стенки.
Таблица N 4. Стерилизация паровым методом
Таблица N 4
|
Давление пара в стерилизационной камере, кГс/см |
Рабочая температура в стерилизационной камере, С° |
Время стерилизационной выдержки, мин |
||||
|
Номина- |
Предельное отклонение |
Номина- |
Предельное отклонение |
При ручном и полуавтоматическом управлении не менее |
При автоматическом управлении |
|
|
Номина- |
Предельное отклонение |
|||||
|
0,20(2,0) |
±0,02(+0,2) |
±2,0 |
+2 |
|||
|
0,11(1,1) |
±0,02(+0,2) |
+2 |
+3 |
|||
|
Применяемость |
Условия проведения стерилизации |
Срок сохранения стерильности |
Применяемое оборудование |
|||
|
Для изделий из коррозионно-устойчивого металла, стекла, изделий из текстильных материалов, резины. Для изделий из резины, латекса и отдельных полимерных материалов |
Стерилизацию производят в стерилизационных коробках без фильтров или с фильтрами, в двойной мягкой упаковке из бязи, в пергаменте, бумаге мешочной, непропитанной, бумаге мешочной влагопрочной, бумаге для упаковки продуктов на автоматах марки Е, бумаге упаковочной высокопрочной, бумаге двухслойной крепированной |
Изделия, простерилизованные в стерилизационных коробках без фильтров, в двойной мягкой упаковке из бязи или пергамента, в бумаге непропитанной и т.д. могут храниться 3 сут. в стерилизационных коробках с фильтром — 20 сут |
Паровой стерилизатор |
|||
Примечание к табл. N 4. Режим работы стерилизатора контролируется химическими индикаторами (Д-манноза, никотинамид, бензойная кислота), запаянные в трубочки индикаторы укладывают в каждый бикс.
Таблица N 5. Стерилизация химическим методом (растворами)
Таблица N 5
|
Стерилизующий агент |
Режим стерилизации |
||||
|
Температура, С° |
Время выдержки, мин |
||||
|
Номинальное значение |
Предельное отклонение |
Номинальное значение |
Предельное отклонение |
||
|
Перекись водорода 6% (по активнодействующему веществу) |
Не менее 18 |
±5 |
|||
|
50 |
±2 |
±5 |
|||
|
Раствор «Дезоксон» N 1 (по надуксусной кислоте) |
Не менее 18 |
±5 |
|||
|
Глютаровый альдегид фирмы «Реанал» (Венгрия), 2,5% (по активнодействующему веществу) рН 7,0-8,5 |
±1 |
||||
|
Стерилизующий агент |
Вид материала |
Способ обработки |
Применяемое оборудование |
||
|
Перекись водорода 6% (по активнодействующему веществу) |
Для изделий из полимерных материалов, резины, стекла, коррозийно- |
Стерилизация должна проводиться при полном погружении изделия в раствор на время стерилизационной выдержки, после чего изделие промывают стерильной водой двукратно. Срок хранения простерилизованного изделия в стерильной емкости (стерилизационная коробка), выложенной стерильной простыней, 3 сут |
Закрытые емкости из стекла, пластмассы или покрытые эмалью (эмаль без повреждений) |
||
|
Раствор «Дезоксон» N 1 (по надуксусной кислоте) |
|||||
|
Глютаровый альдегид фирмы «Реанал» (Венгрия), 2,5% (по активнодействующему веществу) рН 7,0-8,5 |
|||||
Примечания к табл.5:
1. 6% раствор перекиси водорода и 1% раствор «Дезоксон» N 1 повторно использовать для стерилизации изделий медицинского назначения нельзя.
2. Температура в процессе стерилизации не поддерживается.
3. Стерилизацию и промывание проводят в асептических условиях, соответствующих требованиям, предъявляемым к чистым операционным.
VI. Санитарное содержание помещений
1. Все помещения, оборудование, инвентарь должны содержаться в идеальной чистоте.
2. Влажная уборка помещений должна осуществляться с применением моющих и дезинфекционных средств не менее 1 раза в сутки, а при необходимости чаще.
3. Один раз в месяц в помещениях, где проводится работа с нативной кровью, сывороткой, делают генеральную работу с использованием 3% раствора хлорамина, хлорной извести, извести белильной термостойкой.
Во время генеральной уборки тщательно моют стены, оборудование, мебель, проводят очистку полов от наслоений, пятен и т.д.
Генеральные уборки проводят по утвержденному графику.
VII. Транспортировка и хранение биоматериала
1. При транспортировке биоматериал помещают в пробирки, закрывающиеся резиновыми пробками, сопроводительную документацию — в упаковку, исключающую возможность ее загрязнения биоматериалом.
Бланки направлений помещать в пробирку с кровью запрещается.
2. Транспортировка биоматериала осуществляется в закрытых контейнерах, подвергающихся дезинфекционной обработке.
3. При открывании пробок бутылок, флаконов, пробирок с кровью, плазмой или другими секретами следует не допускать разбрызгивания содержимого.
4. При хранении потенциально инфицированных материалов в холодильнике необходимо поместить их в полиэтиленовый пакет.
В случае подтверждения зараженности биоматериала размораживание холодильника совмещают с его дезинфекцией.
5. При аварии (разбрызгивании зараженного биоматериала и т.д.) помещение, где произошла авария, тщательно дезинфицируют.
Объем и вид дезинфекции определяет руководитель КДЛ.
Если авария произошла на центрифуге, то дезинфекционные мероприятия начинают проводить не ранее чем через 30-40 мин, то есть после осаждения аэрозоля. Все случаи аварий и принятые в связи с этим меры подлежат обязательной регистрации во внутрилабораторном журнале по технике безопасности.
6. Для ликвидации последствий аварии в лаборатории необходимо наличие аптечки, содержащей стерильные ватные и марлевые тампоны, 70% спирт, 1% раствор нитрата серебра, 1% раствор протаргола, 0,05% раствор перманганата калия, 1% спиртовой раствор йода, лейкопластырь.
Текст документа сверен по:
Справочник заведующего клинико-диагностической
лабораторией, 2000 год