Содержание
- Аутогемотрансфузия.
- Реинфузии крови.
- Реинфузия крови — показания, противопоказания, эффективность
- ХАРАКТЕРИСТИКА ГЕМОТЕРАПЕВТИЧЕСКИХ И
- 86. Безопасные границы гемодилюции. Кровосберегающие технологии в хирургии. Аутогемотрансфузия. Реинфузия крови. Кровезаменители — переносчики кислорода. Транспортировка больных с кровотечением.
- Кровосберегающие технологии в хирургии: новые возможности
- АУТОТРАНСФУЗИЯ
- Аутодонорство компонентов крови и аутогемотрансфузии
Аутогемотрансфузия.
Аутогемотрансфузия — переливание больному собственной крови, осуществляется двумя способами: трансфузией консервированной крови, заблаговременно взятой от больного и сохранявшейся до операции или на первом этапе её — после стабилизации основного наркоза; реинфузией крови, собранной из серозных полостей и излившейся в них при больших операциях.
Преимущества аутогемотрансфузии перед переливанием донорской крови. 1. исключается опасность осложнений, связанных с несовместимостью, а также заражением инфекционными и вирусными заболеваниями; 2. исключается риск изоиммунизации; 3. предотвращается развитие синдрома гомологичной крови; 4. метод экономичен, так как способствует сохранению запасов донорской крови; 5. возможно проведение трансфузий больным с редкими группами крови; 6. отмечается выраженная клиническая эффективность аутогемотрансфузии — лучшая приживаемость и функциональная полноценность эритроцитов в сосудистом русле реципиента.
Показания к аутогемотрансфузии: 1. оперативные вмешательства, которые могут сопровождаться кровотечением; 2. редкие группы крови у больных или невозможность подбора донорской крови; 4. оперативные вмешательства у больных с нарушениями функций печени и почек.
Противопоказания к аутогемотрансфузии: воспалительные процессы; поздние стадии злокачественных новообразований; глубокие поражения печени и почек; выраженная анемия, лейкопения и тромбоцитопения, выраженный атеросклероз коронарных и мозговых сосудов, беременность или период менструаций.
Для аутогемотрансфузий кровь заготавливают от больных заблаговременно, в дозе, необходимой для восполнения предполагаемой операционной кровопотери. Накопление значительных объемов крови больного возможно путем ступенчато-поэтапного чередования до операции эксфузии и трансфузии ранее заготовленной аутокрови. Основная задача состоит в том, чтобы эксфузия не оказывала отрицательного влияния на организм больного, а консервированная аутокровь, используемая для переливания во время операций, была минимальных сроков хранения.
Абсолютно противопоказано применение метода аутогемотрансфузии в педиатрической практике.
Использование аутоплазмы при возмещении операционной кровопотери — аутоплазмотрансфузия в различных ее вариантах — является одним из важных и перспективных разделов в проблеме аутотрансфузии. Она может применяться в клинической практике широко, так как не требует специального оборудования и оснащения, а лишь организации процесса заготовки плазмы.
Взятие крови для плазмофереза с использованием специальных систем для эксфузии можно производить в операционных, так же как и отделение плазмы от эритроцитов как наиболее оптимальный вариант, Аутоплазма в ходе кровевосполнения может применяться либо как единственная трансфузионная среда, либо в комбинации с донорскими эритроцитами. Абсолютных противопоказаний к применению аутоплазмы не выявлено.
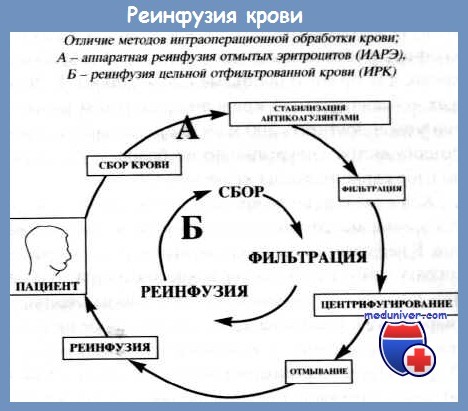
Реинфузии крови.
Реинфузия, или обратное переливание, заключается в использовании крови, излившейся в грудную или брюшную полость в результате разрыва легких, селезенки, печени, нарушения трубной беременности и т.д.
Реинфузия аутокрови предотвращает опасности, связанные с переливанием донорской крови, дает ощутимый экономический эффект.
Показания к реинфузии крови: значительная операционная, послеоперационная, посттравматическая кровопотеря; кровотечения во внутренние полости организма.
Противопоказания к реинфузии крови: гнойное загрязнение излившейся крови; загрязнение излившейся крови кишечным и особенно, толстокишечным содержимым; кровотечения в связи с разрывом матки; почечная недостаточность; операции по поводу злокачественных опухолей.
Следует сказать, что операции по поводу злокачественных опухолей ряд авторов считает относительным противопоказанием к реинфузии. Различают следующие разновидности матода реинфузии:
1. реинфузия крови, излившейся в операционную рану;
2. реинфузия крови, излившейся в сердечные полости до хирургического вмешательства;
3. реинфузия крови при послеоперационных кровопотерях.
Реинфузия крови — показания, противопоказания, эффективность
Обратное переливание пострадавшему собственной крови, излившейся в результате ранения сосудов в серозные полости, возвращая собственные клеточные элементы и иммунные тела, является наиболее физиологичным методом восполнения кровопотери.
Преимущества реинфузии крови заключаются в следущем:
• аутокровь — абсолютно совместимая трансфузионная среда, готовая к немедленному использованию;
• нет необходимости определения групповой и индивидуальной совместимости;
• отсутствует риск реакций непереносимости и переноса вирусных заболеваний;
• эритроциты аутокрови циркулируют в сосудистом русле в 1,5-2 раза дольше донорских эритроцитов и сразу включаются в кровоток, в отличие от донорских эритроцитов, для которых характерно депонирование;
• использование реинфузии крови, являясь эффективным в клиническом плане, дает значительный экономический эффект.
В то же время для крови, собранной из серозных полостей, характерно полное отсутствие фибриногена на фоне высокой фибринолитической и тромбопластической активности, повышенное содержание свободного гемоглобина и ионов калия, что при реинфузии трех и более литров крови может повлиять на показатели гемостаза циркулирующей крови и на полноценность клубочковой фильтрации, особенно при нестабильной гемодинамике .
В 1988 г. нашим сотрудником Н. В. Лебедевым была выполнена научная работа, в которой изучено влияние массивной реинфузии на систему гемостаза у пострадавших с травмой груди и живота. Было выяснено, что кровь, излившаяся в серозные полости при травме внутренних органов и находящаяся там в течение различного времени, претерпевает некоторые изменения. Исследованы образцы крови у 82 пострадавших с травмой груди и живота.
В этой крови было снижено количество эритроцитов до 3,9+0,77 х 1012/л, тромбоцитов до 181+42,4х109/л, увеличено содержание свободного гемоглобина (1,7±0,5 г/л) за счет частичного разрушения форменных элементов. Обращало на себя внимание полное отсутствие фибриногена в излившейся в полость крови, а также повышение ее фибринолитической активности до 27,2±4,7 мин при травме груди и 54+10 мин при травме живота. Уровень плазминогена составлял 1,9±0,1 КЕ/мл, а содержание плазмина — 0,31±0,13 КЕ/мл.
Содержание ингибиторов протеолиза было несколько снижено и в среднем составляло 53,8+1,6 КЕ/мл.
Таким образом, кровь из брюшной полости не отличается от крови из грудной полости, за исключением величины фибринолитической активности плазмы.
Влияние массивной (более 1 л) реинфузии крови на состояние системы гемостаза циркулирующей крови изучено у 44 пострадавших с травмой груди и живота. Анализ системы гемостаза циркулирующей крови у пострадавших с внутриполостным кровотечением (до реинфузии) выявил выраженные гипокоагуляционные изменения. При этом временные показатели тромбоэластограммы (Р и К) были удлинены соответственно на 25% и в 1,5 раза, а максимальная амплитуда (МА) снижена на 20-25%. Содержание фибриногена находилось на уровне нижней границы нормы, а время рекальцификации плазмы было удлинено на 30-35% (составляя в среднем 175+21,5 с при травме живота и 210+21,0 с при травме груди).
Фибринолитическая активность крови была повышена на 11-22% по сравнению со средним уровнем, но не выходила за пределы физиологической нормы. При этом более выраженная активация фибринолиза отмечена в группе больных с ранениями груди, а гипокоагуляционные изменения в большей степени выражены у пострадавших с ранениями живота.
У больных до реинфузии отмечено повышение протеолитической активности циркулирующей крови, что, вероятно, связано с поступлением в кровоток протеолитических ферментов из поврежденных тканей. В то же время антипротеиназный потенциал, который оценивался по содержанию основных ингибиторов протеолиза а1-АТ и а2-МГ, был выше нормы на 25-150%. Количество тромбоцитов в этот период было снижено незначительно -до (220-235)х109/л (при норме (250-350) х109 л).
Переливание пострадавшим 1 л и более крови, изъятой из грудной или брюшной полостей, приводило к кратковременному усугублению гипокоагуляционных изменений. В первые часы после массивной реинфузии показатели R и К тромбоэластограммы удлинялись в 1,5-2 раза, амплитуда МА снижалась на 5-10% по сравнению с исходным уровнем, а величина фибриногена достигала 1,6-1,8 г/л. Время рекальцификации удлинялось до 196+20,9 с после реинфузии крови из брюшной полости и до 231+21,4 с при травме груди. Фибринолитическая активность изменялась незначительно и была в пределах нормы.
Содержание плазмина после реинфузии снижалось до 2,4 КЕ/мл (при норме 3,8-4,2 КЕ/мл,). В этот период наблюдалась тенденция к нормализации протеолитической активности и ингибиторов протеолиза.
Реинфузия оказывала влияние и на тромбоцитарное звено гемостаза: количество тромбоцитов в венозной крови снижалось до (140-180)х109/л, а их агрегационная способность уменьшалась в 1,5 раза по сравнению с нормой.
Состояние выраженной гипокоагуляции сохранялось после реинфузии в течение суток. Однако уже начиная со вторых суток наблюдалась тенденция к нормализации показателей плазменного звена системы гемостаза циркулирующей крови. Так, к концу первых суток после операции и реинфузии уровень фибриногена достигал своих физиологических параметров, время рекальцификации плазмы снижалось до 218+24 с, сокращались временные показатели R и К тромбоэластограммы, максимальная амплитуда удлинялась до 21±2,9 мм при ранениях живота и до 35,9+2,0 мм при ранениях груди. Содержание плазминогена оставалось к концу суток сниженным до 2,55+0,24 КЕ/мл при ранениях живота и 2,97+0,34 КЕ/мл при ранениях груди.
В дальнейшем отмечалась постепенная нормализация показателей тромбоэластограммы, времени рекальцификации плазмы. В течение 6-11 сут после реинфузии в состоянии гемостаза у больных отмечались изменения, характерные для воспалительных и репаративных процессов, сопровождающих посттравматический и послеоперационный периоды: резко увеличивалось содержание фибриногена (до 5-7 г/л), возрастали протеолитическая и антипротеиназная активности крови. Содержание плазминогена к 7-8-м суткам после реинфузии приближалось к физиологическому уровню, достигая 3,4-3,5 КЕ/мл.
Данные тромбоэластограммы свидетельствовали о нормализации коагуляционных свойств крови. Количество и агрегационная способность тромбоцитов к концу наблюдений были в пределах нормы. У обследованных пострадавших не было отмечено клинического проявления ДВС-синдрома в виде различного вида геморрагии или тромботических осложнений.
Таким образом, данные, полученные при исследовании системы гемостаза у пострадавших с ранениями органов грудной и брюшной полостей, позволяют утверждать, что непосредственное влияние реинфузии на состояние гемостаза сказывается только в первые сутки. В последующем развиваются такие изменения в системе гемостаза, которые в целом характерны для патологических состояний, протекающих с воспалительными реакциями. Реинфузия крови на фоне гипокоагуляции не приводит к устойчивым патологическим сдвигам в системе гемостаза, которые требовали бы специфической коррекции.

В настоящее время во всех странах признана высокая эффективность такого метода восполнения кровопотери. Наибольшее распространение получила реинфузия аппаратом Cell Saver. Следует заметить, что еще в 1986 г. Н. В. Лебедевым совместно с инженером Всесоюзного Научно-исследовательского института медицинского приборостроения И. Н. Швырковым был создан и применен в клинической практике у 42 пострадавших с ранениями груди первый в СССР аппарат для реинфузии крови АРПК-1. Однако в силу исторических событий немедицинского характера этот аппарат после демонстрации на ВДНХ был благополучно забыт. (Стоимость аппарата Cell Saver в ценах 2010 г. колеблется от 30 до 50 тыс. евро.)
При использовании аппарата Cell Saver кровь, удаленная из серозной полости, попадает в систему центрифуг, позволяющую отделять эритроциты от плазмы и их промывать. Кровь пропускается сначала через макрофильтр с величиной пор 180-200 мкм, а затем через микрофильтр с величиной пор 20-40 мкм. Отмытые эритроциты, взвешенные в изотоническом растворе хлорида натрия, насосом перекачиваются в емкость для реинфузии. Использование аппаратов Cell Saver позволяет быстро осуществить забор крови из серозных полостей, в течение 5-10 мин ее обработать и начать реинфузию клеточного компонента.
Технология этого процесса сводится к сбору крови в стерильную емкость через фильтры, ее стабилизации, аппаратной фрагментации на компоненты (плазму и клетки), отмыванию клеток, повторную фрагментацию и концентрацию клеточного компонента.
Сбор крови осуществляет хирург с помощью двухпросветной трубки, на наконечник которой по микроканалу со скоростью 40-60 капель в минуту подается раствор антикоагулянта и по основному каналу с разрежением 100-150 мм рт. ст. кровь поступает в стерильный резервуар. В качестве стабилизатора обычно используют стандартный раствор цитрата натрия (АСД) в соотношении 15 мл цитрата на 100 мл крови.
Собранная кровь поступает в сепаратор, где центрифужным методом отделяется основная часть плазменной фракции, а оставшаяся клеточная часть крови разбавляется изотоническим раствором хлорида натрия, что обеспечивает более полное отмывание неизмененных клеток от их фрагментов и оставшейся части плазмы. Оставшийся клеточный компонент представляет собой концентрат клеток в изотоническом растворе, в котором практически нет плазмы (с концентрацией общего белка не более 1,7 г/л). Уровень гематокрита в этом клеточном концентрате составляет около 70 %, уровень гемоглобина — около 200 г/л.
Удаляя 97-98 % белков плазмы, методика Cell Saver обеспечивает освобождение клеточного компонента крови от активаторов плазминогена, плазмина, продуктов распада фибрина и других биологически активных веществ, влияющих на систему гемостаза. Отсутствие фибринолитической активности в компонентах крови, возвращаемых пациенту, позволяет избежать таких нежелательных последствий, как развитие ДВС-синдрома в случаях реинфузии объемов крови, превышающих ОЦК.
В то же время применение аппаратной реинфузии крови сопряжено с рядом трудностей. Во-первых, метод требует полноценного замещения плазменных компонентов путем инфузии не только и не сколько кристаллоидных и коллоидных растворов, сколько больших объемов свежезамороженной плазмы.
Во-вторых, при наличии в серозных полостях большого количества сгустков крови объем забора жидкой крови резко уменьшается, и в таких случаях глобулярный объем приходится восполнять переливанием донорской крови.

При продолжающемся массивном кровотечении может наступить тромбирование всех стерильных магистралей аппарата Cell Saver, что требует их срочной замены.
Резкое уменьшение объема возвращаемого клеточного компонента (по сравнению с объемом забранной крови) наблюдается при попытке подвергнуть реинфузии гемолизированную «старую» кровь. В таких случаях в процессе сепарации удаляются все неполноценные и фрагментированные эритроциты и возвращается не более 20-25 % клеточного компонента.
Наконец, и при аппаратной реинфузии существует проблема микробной контаминации. При ранениях полых органов брюшной полости (в меньшей степени — бронхов) и при массивной кровопотере (более 3,5 л) появляются жизненные показания для реинфузии, например, у пострадавших с редкой группой крови или при отсутствии донорской крови (эритромассы). Как показал опыт НИИ СП им. И. В. Склифосовского, в таких случаях многократное отмывание контаминированной крови позволяет в 10-12 раз снизить уровень контаминации микроорганизмов в клеточном компоненте, реинфузия которого не приводит к бактериемии . С целью профилактики гнойно-септических осложнений этим пациентам проводится антибактериальная и иммунная терапия.
Таким образом, эффективность аппаратной реинфузии крови при ранениях шеи, груди, живота, и тем более при сочетанных ранениях,— несомненна. Но этот метод достаточно дорог. Кроме того, его широкое применение требует создания специальной трасфузиологической службы, введение в состав дежурной бригады специалиста — трансфузиолога. Поэтому во многих стационарах страны реинфузия осуществляется без аппаратов.
Обычно кровь собирают из полостей специальным черпаком в стерильный сосуд емкостью 1000 мл, содержащий 150 мл 4% раствора натрия цитрата (из расчета 15 мл стабилизирующего раствора на 100 мл крови). После стабилизации кровь переливается во флакон для внутривенной инфузии через самодельный фильтр (8 слоев марли). Однако такая методика несовершенна: эвакуация крови происходит слишком медленно, что затрудняет поиск источника кровотечения, открытое переливание из черпака во флакон и из флакона с консервантом в резервуар для реинфузии увеличивает опасность загрязнения крови.
Поэтому большинство хирургов используют закрытые аспирационные системы. Самая простая система состоит в следующем. Пробку стерильного флакона емкостью 500 мл, содержащего 75 мл 4 % раствора цитрата натрия, обрабатывают антисептическим раствором и прокалывают двумя иглами для гемотрансфузии: к длинной игле, конец которой опускают до дна флакона, присоединяют трубку с наконечником, обернутым в несколько слоев марли и забирающим кровь из серозной полости, а к короткой игле — шланг от электроотсоса. После наполнения флакона его переворачивают пробкой вниз и устанавливают в штатив для переливания крови.
Для предотвращения разрушения эритроцитов величина разрежения не должна превышать 100-140 мл рт. ст. Трубка, соединяющая наконечник отсоса с флаконом, должна быть из силиконизированной резины и должна быть цельной, без отдельных отрезков с переходниками, что увеличивает турбулентность крови и ее повреждение в ходе аспирации.
При массивной реинфузии (более 1,5-2 л) для нейтрализации гипокоагуляционного эффекта рекомендуется одновременно вводить фибриноген, раствор аминокапроновой кислоты. Для предупреждения нежелательного побочного действия больших доз цитрата натрия при реинфузии каждых 500 мл аутокрови внутривенно следует вводить 10% раствор хлорида или глюконата кальция.
Показанием к реинфузии является наличие 500 мл и более жидкой крови в плевральных или брюшной полостях. Постоянная готовность дежурных бригад к проведению реинфузии позволяет использовать ее у каждого пострадавшего с кровотечением.
Абсолютных противопоказаний для реинфузии крови в неотложной хирургии практически нет. Считается, что реинфузия противопоказана при повреждении полых органов брюшной полости или крупных бронхов, при длительном (свыше суток) нахождении крови в серозной полости и при выраженном гемолизе.
1. Ранения полых органов. Ясно, что при умеренной кровопотере и стабильном состоянии пострадавшего реинфузия контаминированной крови абсолютно противопоказана. Она противопоказана и при массивной кровопотере, если в наличии имеется достаточное количество компонентов донорской крови. Но как поступить при кровопотере 3-4 л и недостатке донорской крови или отсутствии крови подходящей группы?
К настоящему времени в литературе опубликованы около 400 наблюдений реинфузии контаминированной крови. Все эти наблюдения можно разделить на непреднамеренные и преднамеренные.
Реинфузия контаминированной крови является непреднамеренной, когда хирург собрал большое количество крови и принял решение о начале реинфузии еще до завершения тщательной ревизии органов. Как правило, это происходит в условиях дефицита донорской крови и критическом состоянии пострадавшего. К моменту, когда обнаруживается повреждение полого органа брюшной полости, реинфузии может подвергнуться 1000 мл крови.
На преднамеренную реинфузию хирурги шли в безвыходной ситуации, когда пациент практически погибал, а донорской крови не было в достаточном количестве (или не было вообще).
По данным отечественных и зарубежных авторов — Е. А. Вагнера и соавт.; С.Д.Попова и соавт.; И.И.Дерябина и соавт.; R.N. Smith и соавт.; J.W. Hauer и соавт., во всех этих наблюдениях имелась быстро проходящая бактериемия, которая исчезала под влиянием антибактериальной терапии в течение 3-5 дней. Ни в одном наблюдении у выживших пациентов не развился сепсис. Но при этом многие авторы предостерегают об опасности развития смертельного эндотоксического шока в случае добавления антибиотиков непосредственно в емкость с контаминированной кровью.
В НИИ СП им. Н. В. Склифосовского реинфузия крови при повреждении органов желудочно-кишечного тракта произведена 22 пострадавшим. У пяти пострадавших реинфузия производилась до ревизии органов брюшной полости и выявления повреждения кишечника, у 17 — в связи с тяжелым или терминальным состоянием пострадавшего, вызванным шоком и крово-потерей и недостаточным количеством донорской крови.
Общий объем перелитой аутокрови при ранении органов желудочно-кишечного тракта составил 21 050 мл (в среднем 1 л крови на пострадавшего). Ни в одном случае летальные исходы и осложнения не были связаны с проведением реинфузии крови.
Проведенный клинический анализ позволил нам сделать вывод, что при большой кровопотере, угрожающей летальным исходом, и при отсутствии достаточного количества донорской крови можно пренебречь наличием повреждения полых органов и произвести реинфузию. В подобных случаях обратное переливание излившейся в полости крови может сыграть решающую роль в спасении жизни пострадавшего.
2. Длительная экспозиция крови в серозных полостях. В настоящее время нет оснований полагать, что кровь, находившаяся в плевральной или брюшной полости без повреждения полых органов в течение 24 ч, непригодна для реинфузии. Кровь остается стерильной в течение 2-3 сут, а уровень свободного гемоглобина не превышает 500 мг% (310 мкмоль/л). По жизненным показаниям реинфузию следует применять и через 48 ч: наш опыт показал, что такая кровь остается стерильной, а концентрация свободного гемоглобина не достигает 200 мг% (124 мкмоль/л). Разумеется, чем дольше кровь находится вне сосудистого русла, тем меньше ее биологическая ценность; в ней уменьшается количество эритроцитов и тромбоцитов и увеличивается степень гемолиза.
3. Гемолиз. Патологическое действие гемолиза зависит от степени его выраженности во всем объеме циркулирующей крови, т.е. от концентрации свободного гемоглобина в реинфузируемой крови и от объема реинфузии.
Например, при реинфузии 2 л крови с содержанием свободного гемоглобина 800 мг% (596 мкмоль/л) его концентрация в циркулирующей крови пациента в первые часы достигнет уровня всего 30-40 мг% (18,6-24,8 мкмоль/л). Через сутки концентрация свободного гемоглобина в циркулирующей крови, независимо от степени его повышения сразу после реинфузии, не отличается от физиологической нормы.
Появление интенсивного розового окрашивания плазмы после центрифузирования крови означает, что уровень свободного гемоглобина более 800 мг%, что служит относительным противопоказанием для реинфузии более 2 л такой крови.
— Также рекомендуем «Техника операции при суицидальном ранении шеи — пример»
Оглавление темы «Тактика при ранениях»:
- Техника операции при ранении почки
- Техника операции при ранении двенадцатиперстной кишки
- Техника операции при ранении тонкой кишки
- Техника операции при ранении толстой кишки
- Техника операции при ранении нижней полой вены, брюшной аорты
- Методика ушивания лапаротомной раны при нестабильной гемодинамике
- Диагностическая тактика при множественных и сочетанных ранениях груди
- Восполнение кровопотери при множественных и сочетанных ранениях груди
- Реинфузия крови — показания, противопоказания, эффективность
- Техника операции при суицидальном ранении шеи — пример
ХАРАКТЕРИСТИКА ГЕМОТЕРАПЕВТИЧЕСКИХ И
КРОВЕЗАМЕЩАЮЩИХ СРЕДСТВ
За последние десятилетия существенно пересмотрены показания к переливанию крови. В настоящее время использование цельной крови имеет узкие показания, так как не всегда обосновано её применение с точки зрения получения оптимального лечебного эффекта. Кроме того, переливание крови может представлять опасность для реципиента. При гемотрансфузии больной получает не только необходимые эритроциты, но и небезразличные для него лейкоциты, тромбоциты, белки и антитела. У реципиента происходит образование антител к клеточным элементам и антигенам белков плазмы крови. В дальнейшем у больного (при беременности, необходимости повторного переливания крови) из-за изоиммунизации могут развиться посттрансфузионные осложнения.
Современная трансфузиология базируется на применении компонентной инфузионно-трансфузионной терапии, сущность которой заключается в комплексном и дифференцированном применении трансфузий цельной крови, ее компонентов, препаратов и кровезаменителей. Применение компонентной гематрансфузионной терапии позволяет повысить эффективность лечения и снизить опасность возникновения посттрансфузионных реакций и осложнений.
Благодаря современным достижениям трансфузиологии, мы имеем возможность производить фракционирование крови на ряд компонентов и препаратов, при использовании которых удается получить более выраженный терапевтический эффект, чем при вливании цельной крови. Так при острой и хронической кровопотере целесообразно производить переливание эритроцитной массы; при лейкопении — лейкоцитной массы; при тромбоцитопенических состояниях — тромбоцитной массы; при дефиците ОЦК — плазмы крови.
Фракционирование крови производится с помощью плазмоцитафереза.
По своим клинико-физиологическим свойствам и основным показаниям для трансфузионной терапии все трансфузионные средства делятся на гемотерапевтические и кровезамещающие.
ГЕМОТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА
К гемотерапевтическим средствам относятся:
· Цельная кровь.
-свежецитратная донорская кровь;
-консервированная донорская кровь;
-аутологичная кровь.
· Компоненты крови.
-эритроцитная масса;
-отмытые эритроциты;
-лейкоцитная масса;
-тромбоцитная масса;
-плазма.
· Препараты крови.
-альбумин;
-протеин;
-иммуноглобулин;
-криопреципитат;
-протромбиновый комплекс;
-тромбин;
-гемостатическая губка.
Цельная кровь
Свежецитратная донорская кровь.
Донорская кровь стабилизируется 6 % раствором цитрата натрия в соотношении с кровью 1:10. Используют ее в ближайшие 1-2 часа после забора. Применяется при нарушениях свертывающей системы крови. Переливание свежецитратной крови аналогично прямому переливанию крови.
Гепаринизированная кровь.
Кровь стабилизируется и консервируется гепарином с глюкозой и левомицетином. Хранят гепаринизированную кровь при температуре 4°С не более 1 сут. Применяют ее для заполнения аппаратов искусственного кровообращения.
Консервированная донорская кровь
Донорскую кровь заготавливают с применением одного из консервирующих растворов. Срок годности консервированной крови 21-35 дней в зависимости от вида использованного консерванта. Основное лечебное свойство консервированной крови — заместительное. Способность эритроцитов осуществлять транспорт кислорода сохраняется в течение всего срока хранения. Иммунные свойства сохраняются до 5-7 суток, гемостатические не более 2-3 дней.
Аутологичная кровь
Заготавливаяется заранее перед предстоящими травматичными операциями или используется кровь, излившаяся в серозные полости при закрытых повреждениях. Для стабилизации применяют стандартные консервирующие растворы.
Компоненты крови
Эритроцитная масса — основной компонент крови, состоящий из эритроцитов (70-80 %) и плазмы (20-30 %) с примесью лейкоцитов и тромбоцитов, превосходящий по своему составу, функциональным свойствам и лечебной эффективности при анемических состояниях цельную кровь. От донорской крови она отличается меньшим объемом плазмы и высокой концентрацией эритроцитов. В единице объема эритроцитной массы содержится большее количество эритроцитов, но значительно меньше консервантов, продуктов распада клеток, клеточных и белковых антигенов и антител, чем в цельной крови, что обуславливает ее меньшую реактогенность По внешнему виду эритроцитная масса отличается от консервированной крови меньшим объемом плазмы над слоем, выпавших в осадок эритроцитов. По содержанию эритроцитов одна доза эритроцитной массы (270 ± 20 мл) эквивалентна одной дозе (500 мл) крови.
Эритроцитную массу получают из цельной крови, из которой удаляется 60-65 % плазмы. Разделение осуществляют путем осаждения форменных элементов, которое происходит в результате ее 24-часового хранения при температуре +4°С или центрифугирования.
В зависимости от метода заготовки различают следующие виды ЭМ:
· нативная эритроцитная масса с гематокритом 65-80 %;
· эритроцитная взвесь в ресуспендирующем растворе эритроцифанит или эритронаф ресуспендирующий раствор снижает вязкость и повышает реологические свойства;
· эритроцитная масса, обедненная лейкоцитами и тромбоцитами (эмолт);
· отмытая эритроцитная масса (отмывают 0,9 % раствором хлорида натрия с повторным центрифугированием);
· эритроцитная масса размороженная и отмытая.
При приготовлении трех последних препаратов удаляются белки плазмы, лейкоциты, тромбоциты, микроагреганты и разрушенные при хранении клетки компонентов. Применение отмытых эритроцитов уменьшает вероятность заражения вирусными заболеваниями.
Эритроцитную массу выпускают во флаконах или пластиковых мешках. Хранят при температуре +4°С Сроки ее хранения зависят от применных консервирующих или ресуспендирующего раствора. Эритроцитная масса, полученная из крови, консервированной раствором глюгицирцитроглюкофосфата, хранится 21 день; заготовленная на растворе циглюфад, — до 35 дней; ресуспендированная на растворе эритронаф, — до 35 дней. Отмытую эритроцитную массу хранят при температуре +4°С в течение суток с момента заготовки.
В процессе хранения происходит обратимая потеря эритроцитами функции переноса и отдачи кислорода тканям организма, восстанавление происходит в течение 12-24 часов циркуляции в организме реципиента.
Показания к переливанию эритроцитной массы. Основным показанием к её применению является снижение числа эритроцитов, наступающее в результате острой или хронической кровопотери, неадекватного эритропоэза или гемолиза. При выраженной анемии противопоказаний к переливанию эритроцитной массы нет.
Отмытые и размороженные эритроциты. Их получают из цельной крови (после удаления плазмы), эритроцитной массы или замороженных эритроцитов путем отмывания их в изотоническом растворе или специальных средах. Кровь подвергают 3-5-кратному отмыванию и центрифугированию. При этом удаляются лейкоциты, белки плазмы, тромбоциты, разрушенные клетки, поэтому отмытые эритроциты являются наименее реактогенной трансфузионной средой.
Показания к применению. Отмытые эритроциты показаны для переливания больным, у которых в анамнезе имелись посттрансфузионные реакции негемолитического типа, а также больным, сенсибилизированным к антигенам белков плазмы, тканевым антигенам лейкоцитов и тромбоцитов.
В связи с отсутствием стабилизаторов крови и продуктов метаболизма клеток, оказывающих токсическое действие на организм реципиента, трансфузии отмытых эритроцитов показаны при лечении выраженных анемий у больных с печеночной и почечной недостаточностью, а также при «синдроме массивных гемотрансфузий». Преимуществом их применения является также меньший риск заражения реципиента вирусным гепатитом.
Срок хранения отмытых эритроцитов при температуре +4°С составляет 24 часа с момента их заготовки.
Тромбоцитная масса.Тромбоцитная масса — это плазма, обогащенная тромбоцитами. Получают её из цельной крови центрифугированием и последующим отделением от плазмы, а также методом тромбоцитофереза с помощью автоматических фракционаторов, позволяющих заготавливать от одного донора большие количества тромбоцитов. Храниться при комнатной температуре не более 24 часов, при температуре + 4°С в течение нескольких суток. Чем больше сроки хранения, тем меньше приживляемость тромбоцитов.
Показания к применению. Тромбоцитную массу переливают при тромбоцитопениях различного происхождения (заболевания системы крови, лучевая терапия, химиотерапия), а также тромбоцитопении с геморрагическими проявлениями при массивных гемотрансфузиях.
Тромбоцитная масса имеет такую же маркировку, как и другие трансфузионные среды (цельная кровь, эритроцитная масса). Кроме того, в паспортной части указывается количество тромбоцитов в данном контейнере, посчитанное после окончания их получения. Подбор пары «донор-реципиент» осуществляется по системе АВО и резус-фактору. Непосредственно перед переливанием тромбоцитной массы проверяется маркировка контейнера, его герметичность, сверяется идентичность групп крови донора и реципиента по системе АВО и резус-фактору. Пробу на биологическую совместимость не проводят. При многократных переливаниях тромбоцитной массы, у некоторых больных может возникнуть проблема рефрактерности к повторным трансфузиям тромбоцитов, связанная с развитием у них состояния аллоиммунизации.
Лейкоцитная масса. Лейкоцитная масса- среда с высоким содержанием лейкоцитов и примесью эритроцитов, тромбоцитов и плазмы. Получают её путём цитофереза на фракционаторах непрерывного действия, позволяющих за 2-4 часа припустить через аппарат большие объемы крови и получить от одного донора достаточный объем лейкоцитов. Донору возвращают эритроциты и плазму. Хранят лейкоцитную массу во флаконах или пластиковых мешках при температуре +4-6°С не более 24 ч, целесообразнее переливать свежезаготовленную лейкоцитную массу. Более длительное хранение приводит к истощению энергетического потенциала лейкоцитов и их гибели.
Показания к применению. Основная цель применения лейкоцитной массы коррекция иммунодепрессии различного генеза. Применяют её при иммунодефицитных состояниях, обусловленных гнойно-септическими заболеваниями, лейкопении при цитостатической и лучевой терапии, медикаментозных агранулоцитозах.
Трансфузии лейкоцитной массы производят капельным методом ежедневно до купирования инфекционных осложнений. Профилактическое и лечебное применение переливаний лейкоцитной массы эффективно при частоте трансфузий не менее трех раз в неделю.
Подбор пары «донор-реципиент» осуществляется по системе АВО, с учётом резус-принадлежности (из-за значительной примеси эритроцитов), а также по реакции лейкоагглютинации или по лимфоцитотоксическому тесту. Эффективность заместительной терапии лейкоцитами повышается при подборе их по гистолейкоцитарным антигенам. Обязательно выполняется биологическая проба. Реакции и осложнения могут быть в виде одышки, озноба, повышения температуры тела, тахикардии, падения артериального давления.
Плазма. Плазма — жидкая часть крови, содержащая большое количество биологически активных веществ: белков, липидов, ферментов, гормонов, витаминов и. т. д. Плазма наиболее часто используемый компонент крови. В клинической практике применяют жидкую (нативную), свежезамороженную и сухую (лиофилизированную).
Жидкую (нативную) плазму получают из цельной крови в первые 48 ч с момента заготовки путем либо отстаивания, либо центрифугирования. Хранят при температуре + 4 ± 2°С не более суток.
Свежезамороженная плазма. Получают путем плазмафереза или фракционирования крови. Замораживание должно быть произведено в первые 6 ч после взятия крови у доноров. Замороженную плазму хранят при температуре -25°С в течение 90 дней, при температуре -10°С — в течение 30 дней. Перед применением ее оттаивают при температуре 37- 38°С. В оттаявшей плазме возможно появление хлопьев фибрина, что не препятствует переливанию ее через стандартные пластиковые системы, имеющие фильтры. Признаками непригодности плазмы к переливанию являются появление в ней массивных сгустков, хлопьев, изменение цвета на тусклый серовато-бурый, появление неприятного запаха. Размороженная плазма может храниться не более 1 часа. Повторное замораживание ее недопустимо.
Сухую плазму получают из замороженной в условиях вакуума (лиофилизация). Выпускают во флаконах вместимостью 100, 250, 500 мл. Срок хранения препарата 5 лет. Перед употреблением разводят дистиллированной водой или изотоническим раствором хлорида натрия. Растворённую плазму хранить нельзя.
Показания к применению. Плазма используется с заместительной целью при дефиците ОЦК.
Противопоказаниями к трансфузии плазмы являются тяжелые аллергические заболевания, явлений гиперкоагуляции, тяжелые нарушения функции почек.
Плазму переливают внутривенно капельно или струйно в зависимости от состояния больного Переливание производят с учетом групповой (АВО) совместимости донора и реципиента, обязательно проводится биологическая проба.
В последние годы все чаще применяются специальные виды плазмы: антигемофильная, антистафилококковая, антисинегнойная.
ПРЕПАРАТЫ КРОВИ
Возможность фракционирования белков плазмы крови позволила значительно сократить применение цельной плазмы и внедрить в клиническую практику использование препаратов, получаемых из крови.
Препараты крови делят на три группы (по О. К. Гаврилову):
1. препараты комплексного действия (альбумин, протеин).
2. корректоры свертывающей системы крови (криопреципитат, протромбиновый комплекс, фибриноген, тромбин, биологический антисептический тампон, гемостатическая губка, фибринолизин).
3. препараты иммунологического действия (антирезусный, антистафилококковый, противостолбнячный, противогриппозный иммуноглобулины).
| | | следующая лекция ==> | |
| МЕХАНИЗМ ДЕЙСТВИЯ ПЕРЕЛИТОЙ КРОВИ | | | Препараты комплексного действия |
Дата добавления: 2019-04-03; просмотров: 91;
- ТИП КРОВИ — Совокупность всех эритроцитарных антигенов особи… Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
- Трон в крови — японский фильм, снятый по мотивам *»Макбета» режиссером Акирой *Куросавой … Шекспировская энциклопедия
- АНАЛИЗ КРОВИ — исследование пробы крови с целью уточнения диагноза… Научно-технический энциклопедический словарь
- В КРОВИ — что быть, оставаться Присуще от природы, в характере кого-л. Подразумеваются унаследованные от рождения или воспитанные с детства особые свойства личности… Фразеологический словарь русского языка
- Сейчас как режиком заножу — будешь дрыжками ногать / из крови шея потечёт // из крови живот польётся, будешь помирать как знать — угроза… Живая речь. Словарь разговорных выражений
- В крови — КРОВЬ, -и, о кро́ви, в крови́,… Толковый словарь Ожегова
- до крови — д’о крови и до кр’… Русский орфографический словарь
- до крови — Ср. Вы еще не сражались, подвизаясь против греха. Евр. 12, 4… Толково-фразеологический словарь Михельсона
- До крови — Ср. Вы еще не до крови сражались, подвизаясь противъ грѣха. Евр. 12, 4… Толково-фразеологический словарь Михельсона (ориг. орф.)
- В крови — у кого. Разг. Экспрес. Что-либо свойственно человеку как индивидуальное качество, черта характера. — работаю совсем не из-за денег, а только из любви к делу. У меня это в крови … Фразеологический словарь русского литературного языка
- На крови — Устар. 1. На месте убийства. Сестра Клитинья открылась на духу священнику, что помирает оттого, что хранит страшную тайну — старинный клад, зарытый на крови … Фразеологический словарь русского литературного языка
- Узы крови — Кровное родство. — Ни единое существо, связанное с вами узами крови, не подлежит моему проклятию … Фразеологический словарь русского литературного языка
- КРОВИ — МЕНСТРУАЦИЯ, ИНАЧЕ , МЕСЯЧН. ОЧИЩЕНИЯ ИЛИ РЕГУЛЫ кровотечения из полов. органов, периодически повторяющиеся каждые 4 недели у женщин в период способности к деторождению до угасания их полов. деятельности… Словарь иностранных слов русского языка
- в крови — вошло в плоть и кровь,… Словарь синонимов
- крови — менструация, регулы, месячные, гости, краски,… Словарь синонимов
- узы крови — родственные узы, родственные отношения, родство, кровные… Словарь синонимов
86. Безопасные границы гемодилюции. Кровосберегающие технологии в хирургии. Аутогемотрансфузия. Реинфузия крови. Кровезаменители — переносчики кислорода. Транспортировка больных с кровотечением.
Одним из наиболее эффективных, доступных и наименее затратных методов защиты больного от кровопотери является острая нормоволемическая гемодилюция, при которой часть объема циркулирующей крови замещают кровезаменителями, и операцию начинают при минимально возможном для данного больного уровне гематокрита. Предварительно резервированную аутокровь возвращают пациенту после хирургического гемостаза. Кровь собирают в стандартные пакеты, содержащие антикоагулянт. Применяя данную методику, удаётся обеспечить максимальное сбережение собственной крови больного, реализовать необходимые скорости биологических реакций путём оптимизации кислородотранспортной и газораспределительной функции аутокрови больного, снизить потребность в переливании крови на 18-100%, уменьшить количество периоперационных осложнений .
Существуют два основных методологических подхода к расчёту объёма предварительно резервируемой аутокрови больного :
Первый основан на достижении минимально допустимого для данного больного безопасного уровня гематокрита и гемоглобина и рассчитывается по формуле:
Второй основан на резервировании безопасного для больного (15%) объёма циркулирующей крови.
Для восполнения внутрисосудистого объёма, процесс резервирования аутокрови необходимо рассматривать как кровопотерю среднюю по объёму и острую по быстроте развития, с соответствующим трансфузионным замещением в 200% к объёму резервированной аутокрови и компонентным соотношением – коллоиды : кристаллоиды = 1:1. Предпочтение из коллоидных растворов следует отдавать препаратам гидроксиэтилкрохмала (стабизол, рефортан).
Вышеуказанная методика высокоэффективна и легко применима у большинства больных с периоперационной кровопотерей до 30%. Однако у больных пожилого возраста система транспорта и распределения газов крови функционирует в режиме экономной адаптации, обеспечивающей возможности физиологической регенерации и её напряжение не всегда позволяет реализовать достаточную скорость протекания биологических процессов для репаративной регенерации, вследствие чего применение данной методики может привести к срыву адаптационного функционирования органов и систем с исходно лимитированной доставкой кислорода .
В качестве альтернативы традиционной острой нормоволемической гемодилюции предлагается методика продвинутой острой нормоволемической гемодилюции (ПОНГ), которая адаптирована нами к возможности применения в том числе у лиц пожилого возраста с наличием сопутствующей патологии, прежде всего со стороны сердечно-сосудистой и центральной нервной систем .
Продвинутая острая нормоволемическая гемодилюция
Продвинутая острая нормоволемическая гемодилюция – это комбинация острой нормоволемической гемодилюции, проводимой непосредственно перед оперативным вмешательством и, использование искусственных носителей кислорода как во время проведения последней, так и в ходе оперативного вмешательства.
Под аутогемотрансфузией понимается переливание реципиенту его собственной крови или ее компонентов (плазмы, эритроцитов).
К методам аутогемотрансфузий относятся:
Предоперационная заготовка аутокрови или компонентов (плазма, эритроциты)
Предоперационная и интраоперационная гемодилюция
Интраоперационное «спасение крови» — реинфузии собранной во время операции крови больного.
Предоперационная заготовка аутокрови или компонентов (плазма, эритроциты) производится в плановом порядке в отделении трансфузионной терапии. Оформляется информированное согласие больного на процедуру аутотрансфузии. Врач-трансфузиолог совместно с хирургами определяет предполагаемый объем кровопотери во время операции и необходимое количество аутокрови или ее компонентов для восполнения кровопотери. анализируется состояние больного, показатели крови, устанавливаются противопоказания.
Критерии отбора аутодоноров. Возраст имеет относительное значение. Зарубежные данные свидетельствуют об использовании аутодонорства у пациентов от 8-18 лет в ортопедии (многие сотни наблюдений). При этом обморочные реакции отмечались лишь у 0,05-1% аутодоноров. Верхняя граница практически отсутствует. Американские врачи описывают заготовку двух доз аутокрови у пациентов старше 90 лет с незначительными сосудистыми реакциями у 2,4%. Естественно, что дети и лица старшего возраста нуждаются в более тщательном наблюдении во время заготовки аутокрови.
Аутодонор не должен иметь очагов инфекции. Гемоглобин перед кроводачей должен быть не менее 110 г/л при гематокрите не менее 33%.
Не проводятся аутодонации у онкологических, гематологических больных, больных СПИДом. В целях обеспечения безопасности медицинского персонала не могут быть аутодонорами лица, являющиеся носителями вирусов гепатита В и С, ВИЧ и имеющие положительные реакции на сифилис.
Реинфузией крови называют обратное переливание в сосудистое русло больного крови, теряемой им в результате операции, травмы или патологического процесса. Высокая клиническая эффективность метода реинфузии крови убедительно доказана более чем столетней историей его практического применения. Реинфузия аутокрови предотвращает опасности, связанные с переливанием донорской крови, дает ощутимый экономический эффект. В этом главные преимущества метода. Вопросам изучения и совершенствования метода реинфузии крови в настоящее время посвящается все возрастающее число исследований.
ПОКАЗАНИЯ К РЕИНФУЗИИ КРОВИ
Показанием для проведения реинфузии крови является значительная операционная, послеоперационная, посттравматическая кровопотеря, а также кровотечения во внутренние полости организма. Принципиально можно считать, что любая кровопотеря при условиях, допускающих использование излившейся крови, может быть и должна быть восполнена посредством реинфузии. Реинфузия крови является спасающим больного лечебным мероприятием при неожиданных массивных кровотечениях. Отмечена высокая эффективность реинфузии крови в экстренной хирургии при разрывах селезенки, печени, почек, при нарушенной внематочной беременности, при операциях на крупных сосудах, на органах грудной клетки и при целом ряде других хирургических вмешательств.
ПРОТИВОПОКАЗАНИЯ К РЕИНФУЗИИ КРОВИ
1. Гнойное загрязнение излившейся крови.
2. Загрязнение излившейся крови кишечным и особенно толстокишечным содержимым.
3. Операция по поводу злокачественных опухолей.
4. Кровотечения в связи с разрывом матки.
5. Почечная недостаточность.
Кровезаменители — переносчики кислорода.
«эригем» — 3% раствор гемоглобина, который перед употреблением следует развести изотоническим раствором или дистиллированной водой.
Основные функции препарата:
перенос кислорода;
стимуляция эритропоэза, лейкопоэза;
ускорение тромбопластинообразования.
«Перфторан» — препарат, изготовленный на основе эмульсии перфторуглеродов, обладает газотранспортными, реологическими, гемодинамическими, диуретическими, мембраностабилизирующими, сорбционными свойствами.
Кровосберегающие технологии в хирургии: новые возможности
Актуальной проблемой современной хирургии является восполнение кровопотери в периоперационном периоде. В настоящий момент сформировалась концепция бескровной хирургии, предусматривающая широкое использование кровосберегающих технологий. Выбор методики кровосбережения определяется целым рядом факторов: состоянием больного, экстренностью ситуации, локализацией операции, ресурсами клиники. Наряду с распространенными методами ограничения кровопотери рассматривается возможность использования терлипрессина в качестве компонента кровосберегающих технологий. Описывается механизм действия терлипрессина и сферы его применения. Подчеркивается, что максимальный эффект кровосбережения может быть достигнут при комбинации различных методов. Таблица. Перечень онкологических операций, при которых возможно применение терлипрессина (препарат Реместип)
Одной из наиболее обсуждаемых тем в хирургической клинике является проблема восполнения кровопотери в периоперационном периоде. Коррекция кровопотери у хирургических больных зачастую осложняется наличием исходной анемии. Анемия до операции ассоциируется с ростом количества осложнений в послеоперационном периоде и уровня летальности. Результаты многоцентрового исследования, проведенного на более чем 300 тыс. больных, перенесших хирургические вмешательства, показывают, что даже незначительное отклонение гематокрита повышает 30-дневную летальность и количество кардиологических осложнений. На 1% снижения гематокрита приходится увеличение числа осложнений на 1,6% . Возникновение анемии после хирургических вмешательств также ассоциируется с высоким числом осложнений, в том числе пневмоний и послеоперационного делирия . Наряду с этим переливание компонентов крови во время операции обусловливает рост числа инфекционных осложнений и сроков госпитализации .
Наши представления о кровезамещении в последние десятилетия претерпели существенные изменения. Многие врачи еще помнят принцип восполнения кровопотери «капля за каплей» или рекомендации по переливанию крови с целью стимуляции иммунитета. Однако достижения биохимии, патофизиологии и клинической медицины значительно ограничили показания, а в ряде случаев позволили вообще отказаться от переливания крови и ее компонентов . Эволюцию взглядов на переливание крови лучше всего отражает высказывание французского профессора A. Castaigne: «В 1970 г. кровь была волшебным спасающим средством, в 1980 г. она стала убийцей, с 1991 г. мы знаем, что ни одно переливание крови не бывает безопасным».
В настоящее время проблемы возмещения кровопотери у хирургических больных обусловлены целым рядом факторов. Прежде всего это дефицит компонентов крови, который из года в год только усугубляется. Наглядным подтверждением тому являются объявления на дверях медицинских учреждений и призывы в средствах массовой информации с просьбой сдать кровь. Кроме того, при переливании эритроцитарной массы имеется опасность возникновения различных трансфузиологических реакций в связи с несовместимостью по эритроцитарным антигенам и резус-фактору. Спектр осложнений может варьировать от повышения температуры тела до возникновения гемолитических реакций.
При переливании компонентов крови также возможна передача инфекции: вирусов гепатита В и С, вируса иммунодефицита, цитомегаловируса, вируса простого герпеса и др. .
Любое переливание компонентов крови сопровождается иммунологической реакцией различной степени выраженности. Исследования, проведенные in vitro и in vivo, показали, что переливание крови оказывает влияние как на B-, так и на T-лимфоциты. Установлено, что иммунные нарушения могут возникать даже после переливания одной дозы эритроцитарной массы или плазмы и длиться до 60 дней .
Стоит отметить, что перелитые эритроцитарные препараты не в должной мере повышают кислородотранспортную функцию крови, поскольку при хранении в эритроцитах снижается уровень 2,3-дифосфоглицерата (2,3-ДФГ), что ведет к сдвигу кривой диссоциации оксигемоглобина и ухудшению отдачи кислорода эритроцитами. Для восстановления уровня 2,3-ДФГ в эритроцитах требуется более суток .
Имеются также определенные религиозные ограничения при переливании крови – члены известной общины отказываются от донорской крови и ее компонентов, ссылаясь на формализованное толкование Библии. Приходится сталкиваться
и с юридическими проблемами, когда больные и их родственники, напуганные тенденциозными публикациями в средствах массовой информации, пытаются связать осложнения основного заболевания с компонентным переливанием крови.
Учитывая существующие проблемы, связанные с гемотрансфузиями, можно отметить, что за несколько десятилетий известное высказывание: «…Борьба с кровопотерей всегда была и будет важнейшей задачей хирургии…», принадлежащее академику А.Н. Бакулеву, стало актуальным по меньшей мере еще и для анестезиологии-реаниматологии.
В настоящий момент с учетом реалий и переосмысления возможностей кровезамещения сформировалась так называемая концепция бескровной хирургии. Она предусматривает рациональное использование методик кровосбережения у хирургических больных. Кровосберегающие технологии представляют собой методы, позволяющие уменьшить объем восполняемой кровопотери или компенсировать ее за счет собственной крови пациента. В литературе нет четких рекомендаций о том, какие методы кровосбережения должны использоваться при той или иной патологии. В известной мере выбор кровосберегающих технологий зависит от предпочтения врача и возможностей клиники. Вместе с тем ряд методик кровосбережения, а также показания и противопоказания описаны в приказе Минздрава России № 183 от 1 апреля 2013 г. «Об утверждении правил клинического использования донорской крови и (или) ее компонентов». Он содержит рекомендации по дооперационной заготовке аутоэритроцитов, нормоволемической и гиперволюмической гемодилюции, а также интраоперационной аппаратной реинфузии крови.
Технологии кровосбережения используются на всех этапах периоперационного периода. Безусловно, у каждого метода есть свои показания и противопоказания, определенные ограничения, зависящие от области операции, состояния больного, экстренности хирургического вмешательства. Кроме того, возможна комбинация различных методов. Эффективность кровосбережения зависит от командной работы врачей нескольких специальностей: хирургов, анестезиологов-реаниматологов и трансфузиологов.
Условно кровосберегающие технологии можно разделить по времени их использования: до, во время и после операции.
К дооперационным методикам относятся заготовка аутоэритроцитов, коррекция факторов системы гемостаза, оптимизация антикоагулянтной терапии, а также стимуляция гемопоэза.
При заготовке аутокрови донором является сам пациент. Обычно однократно эксфузируют около 450 мл крови, промежутки времени между ее изъятиями составляют от четырех до десяти дней. Чаще всего заготовка аутокрови выполняется еженедельно, а промежуток между последней эксфузией и операцией составляет не менее трех суток.
При аутогенной гемотрансфузии исключаются реакции, связанные с переливанием несовместимой крови, инфицирование, иммунологическое действие. Имеются психологические преимущества для больного (используется собственная, а не чужая кровь). Однако есть ограничения и ряд противопоказаний: анемия (гемоглобин не ниже 110 г/л, гематокрит не ниже 33%) и сопутствующие сердечно-сосудистые заболевания. К недостаткам также относят высокую частоту невостребованности заготовленной аутокрови, которая достигает 50%.
Важным компонентом концепции бескровной хирургии является коррекция нарушений гемостаза, которая необходима при выявлении отклонений в гемокоагуляционных тестах. Кроме того, актуальна оптимизация использования антикоагулянтов. На смену гепаринам – нефракционированному и низкомолекулярным – приходят новые антикоагулянты, зарегистрированные в России. Это прямой ингибитор тромбина – дабигатрана этексилат (Прадакса) и прямой ингибитор активированного фактора Х – ривароксабан (Ксарелто). К примеру, в травматологии они назначаются после оперативного вмешательства, и соответственно кровоточивость тканей во время операции не увеличивается.
До операции эффективна также стимуляция гемопоэза, для чего назначают эритропоэтины (Эпостим, Эпрекс). В настоящее время их получают с помощью методов генной инженерии. Рекомбинантный эритропоэтин является синтетическим аналогом естественного гормона человека и аналогично эндогенному стимулирует эритропоэз. Обычно для полноценного эритропоэза эритропоэтин комбинируют с препаратами железа. Это позволяет увеличить количество эритроцитов в предоперационном периоде .
Методы кровосбережения операционного этапа условно можно разделить на методы, которые применяют анестезиологи-реаниматологи, и методы, используемые хирургами. К анестезиологическим методам относят прежде всего острую нормоволемическую гемодилюцию. Принцип заключается в заборе у больного непосредственно перед операцией части его крови и замещении этого объема кровезаменителями. При этом объем циркулирующей крови остается прежним. Важно подчеркнуть, что постгемодилюционный уровень гемоглобина должен быть не ниже 90–100 г/л, а уровень гематокрита – не ниже 28%. Этот уровень эритроцитов вполне достаточен для нормального транспорта кислорода. Хотя объем кровопотери во время операции остается прежним, в условиях гемодилюции больной теряет меньше собственных эритроцитов, поскольку кровопотеря идет в значительной степени за счет введенного плазмозаменителя. У метода острой нормоволемической гемодилюции есть определенные ограничения: его не рекомендуется использовать у пациентов с анемией, сердечно-сосудистой патологией, заболеваниями органов дыхания. Кроме того, неожиданная потеря крови в ходе операции может обернуться гиповолемией, падением сердечного выброса и декомпенсацией кровообращения. Это состояние усугубляется исходной гемодилюцией.
Для гемодилюции традиционно использовались препараты гидроксиэтилкрахмала. Однако в последние два года отношение к ним радикально изменилось как в США, так и в Европе. Профессиональные организации наложили ряд ограничений на применение этих растворов из-за риска развития почечного повреждения, требующего проведения почечной заместительной терапии, и увеличения летальности у больных в критических состояниях . При плановых хирургических вмешательствах тоже имеются серьезные ограничения. Так, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) рекомендует отказаться от препаратов гидроксиэтилкрахмала при первых признаках нарушения гемостаза во время операций на открытом сердце в условиях искусственного кровообращения.
С целью кровосбережения достаточно давно используются препараты, ингибирующие фибринолиз: апротинин, эпсилон-аминокапроновая кислота и транексамовая кислота. Применение апротинина ограничено, поскольку было доказано, что его назначение увеличивает риск тромботических осложнений и смертельных исходов . Использование эпсилон-аминокапроновой кислоты и транексамовой кислоты основано на их способности обратимо связываться с плазминогеном, тем самым блокируя его связь с фибрином и последующий фибринолиз. Эффективность транексамовой кислоты при этом в восемь раз выше, чем эпсилон-аминокапроновой .
Имеются многочисленные работы, демонстрирующие, что назначение транексамовой кислоты сопровождается уменьшением кровопотери и потребностей в переливании компонентов крови. Эффект доказан при сердечно-сосудистых операциях, трансплантации печени, торакальных вмешательствах, протезировании крупных суставов, урологических и гинекологических вмешательствах, при травмах . Действительно, при операциях на легких, почках, предстательной железе и матке имеется патофизиологическая составляющая применения транексамовой кислоты – эти органы содержат повышенное количество активаторов плазминогена. Избыточная кровоточивость во время оперативного вмешательства, да и после операции, может быть устранена назначением ингибиторов фибринолиза. В других случаях, применяя ингибиторы фибринолиза, можно потенциально увеличить риск тромботических осложнений. На практике для профилактики тромбоэмболических осложнений широко используется перемежающая пневматическая компрессия нижних конечностей, в том числе и с целью активации эндогенного фибринолиза . По этой причине во всех работах, посвященных применению транексамовой кислоты, красной нитью проходит мысль о ее небезопасности в отношении тромботических осложнений. В этом отношении представляют интерес результаты недавно опубликованного кумулятивного метаанализа . Авторы делают вывод, что влияние транексамовой кислоты на тромбоэмболические осложнения и летальность до конца не изучено, требуется проведение дальнейших исследований.
Перспективным методом кровосбережения является реинфузия крови из области операции во время хирургического вмешательства или в послеоперационном периоде. При этом собранную кровь подвергают предварительной обработке: фильтруют, центрифугируют и отделяют плазму от эритроцитов, которые затем отмывают и возвращают больному. Однако больному возвращается только 50% собранных эритроцитов, остальные подвергаются гемолизу или теряются по другим причинам. Самыми совершенными аппаратами для реинфузии являются так называемые сел-сейверы (cell saver). Однако значительная стоимость этих аппаратов и необходимого расходного материала ограничивает их широкое применение. Обычно они используются при предполагаемой кровопотере более одного литра. Кроме того, реинфузия крови невозможна при попадании в рану кишечного содержимого, гноя или иных примесей.
Управляемая гипотензия с помощью фармакологических препаратов также позволяет уменьшить кровопотерю. Однако подобное воздействие вовлекает в процесс практически всю сосудистую систему больного, в результате чего возможны существенные проблемы с гемодинамикой и микроциркуляцией, особенно у пожилых пациентов и больных с сопутствующей патологией в виде ишемической болезни сердца или гипертонической болезни .
К хирургическим методам кровосбережения относят: рациональную программу операции, использование малоинвазивных методов вмешательства, гемостатические инструменты (лазерный скальпель, аргонный коагулятор и др.), блокаду сосудов до рассечения, клипирование сосудов, предварительную эмболизацию артерий и различные местные гемостатики .
В послеоперационном периоде важным является ограничение количества проб для анализов, рациональная антикоагулянтная терапия.
К новым методам кровосбережения во время хирургических вмешательств, которые находят все большее распространение, относится использование терлипрессина. В России этот препарат доступен под названием Реместип («Ферринг Фармасетикалз»). Терлипрессин
(N-триглицил-8-лизин-вазопрессин) – синтетический аналог гормона задней доли гипофиза – вазопрессина. От вазопрессина терлипрессин отличается тремя дополнительными глициновыми остатками, соединенными с N-концом молекулы, и замещением в восьмой позиции аргинина лизином .
В организме человека после отщепления глициновых остатков терлипрессин превращается в биологически активный лизин-вазопрессин, его максимальная концентрация в плазме крови достигается через 120 минут. Расщепление терлипрессина практически полностью осуществляется посредством метаболического преобразования эндопептидазами, почками выделяется около 1% препарата. Фармакологическое действие терлипрессина проявляется сосудосуживающим эффектом артериол, венул и вен висцеральных органов, что приводит к уменьшению их кровоснабжения, в том числе и к снижению портального кровотока и портального давления. Описанные эффекты связаны в основном с воздействием метаболитов терлипрессина на тип V1A вазопрессиновых рецепторов. Изменение химической структуры вазопрессина привело к увеличению длительности действия препарата и уменьшению побочных эффектов. Это позволяет вводить его болюсно, а не в виде длительной внутривенной инфузии .
Назначение терлипрессина включено в стандартные схемы лечения больных с кровотечениями из варикозно-расширенных вен пищевода при портальной гипертензии. Было доказано, что введение терлипрессина сопровождается уменьшением потребности в гемотрансфузиях у этой категории больных, кроме того, достоверно снижалась летальность. Таким образом, у хирургических больных с кровотечениями из варикозно-расширенных вен пищевода был установлен кровосберегающий эффект терлипрессина .
Имеются данные о применении терлипрессина во время трансплантации печени у больных с хронической печеночной недостаточностью в терминальной стадии. Внутривенное введение терлипрессина сопровождалось стабилизацией артериального давления и возрастанием общего сосудистого сопротивления на фоне уменьшения портального давления. Важно заметить, что уровень лактата не отличался от показателей контрольной группы, что свидетельствовало о достаточном уровне оксигенации тканей .
Интерес хирургов к терлипрессину вызван его способностью уменьшать интенсивность кровоснабжения в органах брюшной полости и малого таза, что сокращает объем кровопотери при проведении хирургических манипуляций. При этом кровопотеря уменьшается как за счет снижения кровоснабжения, так и за счет улучшения условий оперирования («сухое поле»). Здесь важна хорошая управляемость препарата и возможность достигать заданных хронометрических показателей действия лекарственного средства. Немаловажными являются и данные, полученные при пересадке печени: введение терлипрессина не сопровождалось увеличением лактата, а значит, ткани не страдали от недостатка кислорода в условиях вазоконстрикции.
В работе В.В. Баринова и соавт. были проанализированы возможные оперативные вмешательства, где кровосберегающий эффект терлипрессина наиболее демонстративен (таблица) .
К преимуществам терлипрессина стоит отнести возможность его применения как в плановой, так и экстренной хирургии. При этом назначение препарата не требует специальной подготовки пациента. Кроме того, введение терлипрессина сопровождается стабилизацией гемодинамики у больных с гиповолемией, обусловленной кровопотерей или иными причинами.
Таким образом, спектр кровосберегающих технологий постоянно расширяется за счет внедрения новых фармакологических препаратов. Безусловно, выбор конкретной методики зависит от состояния пациента, степени ургентности операции, ее локализации и многих других факторов. Хочется подчеркнуть, что появление препаратов с новыми свойствами, подобных терлипрессину, расширяет спектр методов кровосбережения. Причем назначение таких препаратов не противопоставляется имеющимся методам, а дополняет их. Конечным результатом использования кровосберегающих технологий является улучшение качества оказания хирургической помощи и повышение безопасности больного.
АУТОТРАНСФУЗИЯ
АУТОТРАНСФУЗИЯ (от греч. autos—сам, лат. trans—через и fundo—лью), переливание б-ному его собственной крови. Простейший способ А. — переливание крови из периферии (с конечностей больного) 54 5 внутренним, важным для жизни органам. Напр., перед ампутацией нижней конечности в течение некоторого времени держать ногу в приподнятом положении или (при отсутствии воспалительных явлений) перед операцией выжать из конечности кровь путем тугого бинтования (широко распространено при ампутациях по поводу ранений). При внутренних кровотечениях (внематочная беременность, ранения и разрывы паренхиматозных органов брюищой полости — печени, селезенки и поджелудочной железы, органов грудной полости—легких и сердца) применяется модификация, являющаяся, в сущности, одним из видов переливания крови (см.). Способ заключается в том, что по нахождении кровоточащего места и остановке кровотечения жидкую излившуюся кровь собирают из полости ложками или марлевыми салфетками и выжимают в сосуд с 10% раствором Natrii citrici, который прибавляется с таким расчетом, чтобы его содержалось в собранной крови до 0,4%. Собранная кровь фильтруется через несколько слоев марли, разбавляется в желательной пропорции солевым раствором и вливается в вену локтевого сгиба или, при гинекологических операциях, в одну из вен широкой маточной связки. Противопоказанием является одновременное ранение кишечника вследствие возможности инфекции. По той же причине не рекомендуется вливать кровь, находившуюся слишком долго (больше суток) в полости брюшины, так как в таких случаях возможно пропотевание бактерий или их токсинов через стенки кишек и инфицирование крови. Аутотрансфузия в наст, время не имеет широкого применения. 
Аутодонорство компонентов крови и аутогемотрансфузии
Достоинствами лечебного мероприятия, включающего в себя получение у больных, которые являются для себя одновременно донорами и реципиентами, крови или ее компонентов (аутоэритроцитной массы или взвеси, плазмы свежезамороженной, тромбоцитного концентрата), и последующее возвращение (переливание) забранного (аутодонорство), являются отсутствие аллоиммунизации, исключение риска передачи инфекций, существенное уменьшение риска трансфузионных реакций, меньшая потребность в аллогенных компонентах крови, стимуляция эритропоэза, благодаря чему обеспечивается большая безопасность заместительной трансфузионной терапии компонентами крови. Именно поэтому аутодонорство как лечебное трансфузиологическое мероприятие применяется все более часто.
7.5.1. Показания для аутодонорства. Основными показаниями для применения аутотрансфузий переносчиков газов крови или плазмы являются:
Сложные и объемные плановые хирургические операции с предполагаемой кровопотерей более 20% объема циркулирующей крови (ортопедия, кардиохирургия, урология). У беременных женщин в третьем триместре при наличии показаний к плановому кесаревому сечению возможно проведение аутодонорской заготовки плазмы в объеме до 500 мл.
Пациенты с редкой группой крови и невозможностью подбора адекватного количества донорских компонентов крови.
Отказ пациентов от трансфузии аллогенных компонентов крови по религиозным мотивам при наличии показаний к трансфузии компонентов крови во время планового хирургического лечения.
Существуют следующие методы проведения аутологичных трансфузий:
Предоперационная заготовка аутокрови или аутоэритроцитной массы или взвеси, позволяющая собрать за 3-4 недели до планового хирургического вмешательства 3-4 дозы (до 1000-1200 мл аутокрови консервированной или 600-700 мл аутоэритроцитной массы);
предоперационная нормоволемическая или гиперволемическая гемодилюция, предполагающая заготовку 1-2 доз крови (600-800 мл) непосредственно до операции или начала анестезии с обязательным восполнением временной кровопотери солевыми растворами и плазмозаменителями с поддержанием нормоволемии или гиперволемии;
интраоперационная реинфузия крови – сбор во время операции из операционной раны и полостей излившейся крови с обязательным последующим отмыванием и возвратом в русло крови реципиента аутокрови полостной, консервированной, фильтрованной для реинфузии. Такая же процедура возможна при использовании дренажной крови, получаемой в стерильных условиях при послеоперационном дренировании полостей тела.
Каждый из этих методов может применяться отдельно или в различных сочетаниях. Возможно одновременное или последовательное применение переливаний аутологичных компонентов крови с аллогенными.
7.5.2. Условия проведения эксфузии компонентов крови у аутодонора. Аутодонорство повышает безопасность трансфузии для конкретного пациента. Аутологичная донация компонентов крови применяется с целью снижения риска посттрансфузионных осложнений. Больной должен дать письменное согласие на заготовку аутокрови или ее компонентов, которое фиксируется в истории болезни. Лечащий врач больного должен информировать его об особенностях донации компонентов крови, возможных реакциях (раздел 1 настоящей инструкции). Тестирование аутокрови и ее компонентов аналогично таковому для аллогенных компонентов крови. При маркировке аутологичной крови или ее компонентов на этикетке должна быть фраза «для аутологичной трансфузии».
Критерии допуска к донации аутокомпонентов крови в целом те же, что и для обычных доноров. Для аутодоноров нет верхней границы ограничения по возрасту, в каждом конкретном случае решение о возможности аутодонорства решают совместно лечащий врач и трансфузиолог с учетом мнения пациента или его законных представителей. Нижний возрастной предел определяется физическим развитием и соматическим состоянием ребенка, а также выраженностью периферических вен. Как правило, аутотрансфузии компонентов крови используются у лиц от 5 до 70 лет.
7.5.3. Предоперационная заготовка аутокомпонентов крови. Объем разовой кроводачи для лиц с массой тела более 50 кг не должен превышать 450 мл. При массе тела менее 50 кг объем кроводачи – не более 8 мл/кг массы тела. Лица с массой тела менее 10 кг к терапевтическому аутодонорству не допускаются. Количество антикоагулянтного раствора уменьшается пропорционально количеству эксфузируемой крови.
Уровень гемоглобина у аутодонора перед каждой кроводачей не должен быть ниже 110 г/л, гематокрита — не ниже 33%.
Частота аутологичных кроводач определяется лечащим врачом и трансфузиологом. При этом следует учитывать, что объем плазмы и уровень общего белка и альбумина восстанавливается через 72 часа, т.е. последняя кроводача перед плановой операцией должна быть выполнена за 3 суток.
Большинство аутодоноров, особенно при заготовке более чем одной дозы крови, должны получать таблетированные препараты железа. Известно, что скорость эритропоэза ограничена адекватным количеством железа в организме, которое равно примерно 2 г для женщин и 3 г для мужчин. Каждая донация 1 дозы крови снижает запасы железа на 200 мг (примерно, 1 мг на 1 мл эритроцитов). Прием препаратов железа начинают до первой кроводачи. В ряде случаев для ускорения образования эритроцитов целесообразно одновременное назначение эритропоэтина. Назначение препаратов железа и эритропоэтина аутодонору должно быть согласовано с лечащим врачом.
Хранение аутокрови или ее компонентов проводится по тем же правилам, что и для гомологичных компонентов крови.
Не допускаются к аутодонорству лица с установленным очагом инфекции (любым, необходима предварительная санация) или бактериемией, при верификации нестабильной стенокардии, стеноза аорты серповидноклеточной анемии. Выявленная тромбоцитопения (количество тромбоцитов ниже 180х109/л) также служит основанием для отвода от аутодонорства.
Положительное серологическое тестирование аутореципиента на ВИЧ, гепатит и сифилис является противопоказанием к использованию аутодонорства.
Частота побочных реакций при проведении заготовки аутокомпонентов крови аналогична общей донорской практике и составляет от 2 до 5% всех донаций. Чаще всего встречаются вазовагальные реакции на временную кровопотерю (обморок, головокружение, нарушение сердечного ритма, нерезкое снижение систолического артериального давления). Помещение, где проводится эксфузия крови у аутодоноров, должно быть оснащено для проведения мероприятий возможной интенсивной терапии, а персонал -соответствующим образом подготовлен.
Предтрансфузионный контроль аутологичной переносчиков газов крови проведение проб на ее совместимость с реципиентом и биологической пробы подлежит выполнению врачом, непосредственно переливающим эту трансфузионную среду, как и в случае применения компонентов аллогенной крови, особенно если используются и донорские, и аутодонорские компоненты крови.
В целом, предоперационная заготовка аутокрови или ее компонентов не должна ухудшить состояние больного до операции.
В большинстве случаев программа аутодонорства предусматривает сбор, краткосрочное хранение и переливание цельной консервированной аутологичной крови и аутоэритроцитной массы или взвеси. Однако возможно аутодонорство плазмы, тромбоцитов.
Аутоплазма свежезамороженная, получаемая из аутологичной крови, может быть заготовлена в терапевтически значимых количествах (500 — 1000 мл) в плановых условиях и с успехом применена при отягощенном кесаревом сечении в акушерстве, в сердечно-сосудистой хирургии и ортопедии.
Аутологичный концентрат тромбоцитов и аутоплазма свежезамороженная могут быть использованы при операциях с искусственным кровообращением в сердечно-сосудистой хирургии, где нередко наблюдается тромбоцитопения в послеоперационном периоде. Заготовленный за 3-5 дней до операции аутотромбоцитный концентрат хранится при комнатной температуре (20-24°С) в условиях постоянного перемешивания и переливается во время операции или сразу после нее, что существенно уменьшает объем послеоперационной кровопотери.
7.5.4. Предоперационная гемодилюция. Достоинство подобного метода аутодонорства заключается в том, что во время операции пациент теряет кровь с меньшим содержанием эритроцитов, чем он имел до проведения гемодилюции. Последующая трансфузия несколькими часами ранее заготовленной цельной консервированной аутологичной крови, преимущественно после окончания основной хирургической кровопотери, позволяет быстро повысить концентрацию гемоглобина, коагуляционных факторов, уровень тромбоцитов и объем крови.
Гемодилюция может быть изоволемической, при которой сохраняется и поддерживается исходный (нормальный) объем циркулирующий крови, в котором лишь временно уменьшается объем и концентрация клеток крови. Возможна и гиперволемическая гемодилюция, при которой врач перед предстоящей массивной кровопотерей идет на увеличение внутрисосудистого циркулирующего объема крови выше нормы за счет избыточного переливания плазмозаменителей под контролем гемодинамики и центрального венозного давления, тем самым также снижая потерю эритроцитов во время операции.
Предоперационная гиперволемическая гемодилюция не показана больным с выраженной коронарной недостаточностью, тяжелыми нарушениями ритма сердца, гипертонией (систолическое АД более 180 мм рт.ст.), тяжелыми поражениями легких с респираторной недостаточностью, почек, печени, нарушениями в системе свертывания, при наличии очагов инфекции.
Больной должен быть заранее информирован о проведении предоперационной гемодилюции, на которую он дает свое согласие, фиксируемое в истории болезни (раздел 1 настоящей инструкции). Лечащий врач и трансфузиолог в истории болезни обосновывают необходимость проведения гемодилюции. Проводит предоперационную гемодилюцию трансфузиолог или специально подготовленный врач. Непосредственно перед началом процедуры измеряется и фиксируется АД, пульс, уровень гемоглобина и гематокрита. Пунктируются две вены – одна для эксфузии, другая для восполнения. При невозможности пункции второй вены эксфузия и восполнение чередуются.
Эксфузированный объем крови восполняется солевыми растворами (3 мл на каждый мл изъятой крови) или коллоидами (1 мл на каждый мл собираемой крови). Количество забираемой крови варьирует, но постгемодилюционный уровень гемоглобина не должен быть ниже 90-100 г/л, а уровень гематокрита – не менее 28%. Кровь собирается в стандартные пластикатные контейнеры для крови, содержащие гемоконсервант. Ведется протокол гемодилюции, в котором фиксируется состояние больного, объем эксфузируемой крови, объем восполнения, состояние гемодинамики, время начала и окончания процедуры.
Контейнер с цельной консервированной аутологичной кровью или тщательно маркируется: день, час, фамилия больного, название среды; если контейнеров несколько, то их порядковый номер. Интервал между эксфузией и реинфузией не должен быть более 6 часов, в противном случае контейнеры с кровью должны быть помещены в холодильник с температурой 4°С. Из операционной контейнеры с цельной консервированной аутологичной кровью при проведении предоперационной гемодилюции не выносятся.
Переливание цельной консервированной аутологичной крови начинается, как правило, после окончания этапа операции, связанного с наибольшей кровопотерей. Доза аутокрови, заготовленная последней, переливается первой. Переливается аутокровь через стандартные системы для переливания с фильтром.
Нормоволемическая гемодилюция проводится или до введения больного в наркоз или после вводного наркоза, но до начала операции. В последнем случае аутокровь забирается оксигенированной, поскольку искусственная вентиляция легких, проводимая во время наркоза в режиме умеренной гипервентиляции, способствует повышению содержания кислорода в венозной крови. Во время основного наркоза и операции необходим контроль гемодинамических показателей, почасового диуреза, газов крови с целью поддержания нормальной оксигенации тканей и нормоволемии, обеспечивающей адекватную перфузию органов.
Гиперволемическая гемодилюция проводится по тем же принципам, что и нормоволемическая, но при этом поддерживают уровень гематокрита в пределах 23-25%, используя для замещения зксфузируемой аутокрови растворы гидрооксиэтилкрахмала или 5-10% альбумина.
7.5.5. Интраоперационная реинфузия крови. Реинфузия крови, теряемой во время операции, предполагает аспирацию такой крови из операционной раны или полостей тела стерильным отсосом в стерильную емкость с последующим отмыванием, а затем возврат реципиенту во время операции или в срок, не превышающий 6 часов после начала сбора. Применение интраоперационной реинфузии крови показано только при тех обстоятельствах, когда предполагаемая кровопотеря превышает 20% объема циркулирующей крови, что наблюдается в сердечно-сосудистой хирургии, при разрыве внематочной беременности, в ортопедической хирургии, в травматологии.
Противопоказана интраоперационная реинфузия крови при ее бактериальном загрязнении, попадании амниотической жидкости, при отсутствии возможности отмывания излившейся во время операции крови.
Излившаяся в полости тела кровь отличается по своему составу от циркулирующей крови. В ней снижено содержание тромбоцитов, фибриногена, 2,3-дифосфоглицерата, высок уровень свободного гемоглобина, имеются продукты деградации фибриногена. В какой-то степени эти недостатки нивелируются в процессе обязательного отмывания эритроцитов перед реинфузией.
Фильтрование излившейся крови через несколько слоев марли в настоящее время недопустимы. Созданы специальные приборы для проведения интраоперационного сбора и отмывания крови, теряемой во время операции.
8. Переливание корректоров плазменно-коагуляционного гемостаза
Плазма является жидкой частью крови, лишенной клеточных элементов. Нормальный объем плазмы составляет около 4% общей массы тела (40-45 мл/кг). Компоненты плазмы поддерживают нормальный объем циркулирующей крови и ее жидкое состояние. Белки плазмы определяют ее коллоидно-онкотическое давление и баланс с гидростатическим давлением; они же поддерживают в равновесном состоянии системы свертывания крови и фибринолиза. Кроме того, плазма обеспечивает баланс электролитов и кислотно-щелочное равновесие крови.
В лечебной практике используются плазма свежезамороженная, нативная, криопреципитат и препараты плазмы: альбумин, гамма-глобулины, факторы свертывания крови, физиологические антикоагулянты (антитромбин III, белок С и S), компоненты фибринолитической системы.