Содержание
- Назначение анализа на выявление энтеровируса и методы его проведения
- Назначение анализа
- Когда применяется
- Виды исследований
- ИФА
- Enterovirus, РНК [ПЦР]
- Вирусологический метод диагностики
- Вирусологические методы исследования
- Вопрос 17. Методы микробиологической диагностики вирусных инфекций.
- Вопрос 18. Что такое вирусоскопический метод диагностики?
- Вопрос 19. Что такое вирусологический метод диагностики?
- Методы лабораторной диагностики вирусных инфекций
Назначение анализа на выявление энтеровируса и методы его проведения
Статью подготовил: Василий Бабкинский Врач высшей категории
В настоящее время насчитывается более ста серотипов энтеровирусов. Эта инфекция распространена по всему миру. Она может протекать как бессимптомно, так и с множеством клинических проявлений: от небольшого недомогания с диареей вплоть до развития серьезных заболеваний (серозный менингит, миокардит, паралич).
 Энтеровирусы – очень распространены, заразиться может каждый
Энтеровирусы – очень распространены, заразиться может каждый
Для диагностирования энтеровирусной инфекции врач проводит комплексную оценку проявляющихся симптомов патологии, а также проводит сбор эпидемиологических данных. Поскольку заражение данным возбудителем выявляется довольно часто, то и анализ на энтеровирус – один из наиболее используемых лабораторных методов.
Назначение анализа
Для подтверждения того, что у пациента имеется энтеровирусная инфекция, используются различные методы диагностики. Они являются довольно специфическими вирусологическими методиками.
Поражение вызывает энтеровирус, который содержит РНК. В организм он попадает через желудок, где и размножается, а затем через кровь разносится по организму. Вирус проникает в клетки эпителия, а затем в мышцы и довольно часто поражает нервную систему. Поэтому для исследований берутся каловые массы, смывы из органов зрения и мазок из зева на энтеровирус. Для подтверждения того, что у пациента имеется инфекция, зачастую необходимо использовать различные методики.
При подозрении на наличие энтеровируса в организме необходимо пройти диагностику как можно быстрее.
Именно на начальном этапе развития патологии концентрация вирусов наибольшая. Энтеровирусы обнаруживаются в фекалиях на протяжении 14 дней после инфицирования, в носоглотке – не более семи. После перенесенного заболевания вирусы остаются в организме у человека до 15 месяцев.
Читать так же: какие правила необходимо соблюсти при заражении энтеровирусной инфекцией. При подозрении на энтеровирус, очень важно выполнить анализы
При подозрении на энтеровирус, очень важно выполнить анализы
При выполнении анализов на энтеровирусную инфекцию используются различные способы исследования, каждый из которых ориентирован на достижение одной цели:
- Направленность серологических методов – на выявление антител к инфекции, вырабатываемых организмом в ответ на инфицирование. Ранними маркерами являются IgА , IgМ.
- Вирусологические методики направлены на то, чтобы выделить из взятого материала энтеровирус при помощи выращивания образцов на чувствительных культурах. К иммуногистохимическим способам относятся такие доступные исследования, как иммунопероксидазный и иммунофлюоресцентный анализы.
- При выполнении молекулярно-биологических исследований определяется генетический материал непосредственно самого энтеровируса.
Когда применяется
Пик заболеваемости из-за энтеровирусов начинается летом. Путь передачи инфекции – фекально-оральный. Размножаться вирус начинает в желудке и из его оболочек попадает в кровь. Происходит поражение внутренних органов. Энтеровирус может быть обнаружен в секретах человека, фекалиях, а в некоторых случаях в спинномозговой жидкости или крови.
 Вирус можно обнаружить в мазке из зева
Вирус можно обнаружить в мазке из зева
Для того чтобы подтвердить такой диагноз, как энтеровирусная инфекция, необходимо выделить вирус в культуре самих клеток. Несмотря на то, что в образцах из зева, отделяемого носоглотки или из кала вирус выделяется во многих случаях, это не является доказательством особой важности этого исследования. Возможно наличие в организме сопутствующей инфекции, протекающей бессимптомно. В этом случае выделение вируса в организме может происходить неделями.
Анализ кала на энтеровирус довольно часто указывает на наличие заболевания. При этом в исследуемом материале выявление причинного фактора возможно выполнить на довольно длительном временном отрезке развития патологии. В то же время анализ из зева на энтеровирус более ценен в качестве подтверждения диагноза, поскольку вирус здесь содержится не так длительно в случае бессимптомного развития болезни.
В других взятых образцах на исследование (кровь, спинномозговая или другие жидкости и ткани) вирус выделяют значительно реже. Иногда инфекционный агент получается выделить лишь из крови. Это подтверждает важность взятия различных проб.
Виды исследований
Для выявления инфекции чаще всего используется методика определения РНК энтеровируса в кале. Такое исследование требуется проводить не позже чем через пять дней после проявления первых симптомов заболевания (понос, светлый кал, боли в области живота, повышение температуры, конъюнктивит, проблемы дыхания). Следует помнить, что в кале через неделю от начала болезни концентрация вируса существенно снижается.
 Также следует сдать анализ крови
Также следует сдать анализ крови
Одним из первичных анализов, назначаемых врачом при подозрении на энтеровирус, является сдача крови. Общий анализ на начальной стадии заболевания показывает повышение уровня лейкоцитов и нейтрофилов. Лимфоциты при энтеровирусе, как и эозинофилы, повышаются по мере развития патологии.
Анализ на антитела
Иммуноглобулины, являясь белковыми молекулами, выполняют особые функции. В некоторых случаях они находятся в свободном состоянии в крови, но иногда целенаправленно прикрепляются к поверхности определенных клеток. Это происходит при распознании чужеродных тел. Их прикрепление и служит сигналом для иммунной системы для нейтрализации «нарушителей».
Для выявления иммуноглобулинов, которые называют по-другому антителами к энтеровирусу, проводится специальное исследование ИФА – иммуноферментный анализ. Он основывается на способности самого организма вырабатывать защитные тела, направленные против инфекции. Для его проведения требуются специальные реактивы. Кроме того, что ИФА позволяет диагностировать в целом инфекцию, с его помощью определяется и конкретный серотип возбудителя. Сроки изготовления анализа – 3–4 рабочих дня.
Узнать об особенностях этой инфекции и ее лечении можно из этого ролика:
Исследование кала
Для исследования на энтеровирус кал необходимо собирать в пластиковую или стеклянную посуду. Контейнеры обычно выдаются в регистратурах медицинских учреждений. Следует брать среднюю фекальную массу, объем которой должен быть равен половине или одной чайной ложке.
Нельзя собирать кал после проведения клизмы или введения ректальных свечек. Не следует принимать медикаменты перед забором фекалий.
Каловые массы не должны содержать мочу. В связи с этим от нее надо «избавиться» предварительно. Нельзя собирать материал из памперсов. Доставка фекалий должна быть в день их забора. РНК вируса в каловых массах может оставаться в течение месяца и даже более после начала инфицирования.
 Обязательно проводится анализ кала
Обязательно проводится анализ кала
В результате диагностики специалисты могут выдать как положительный, так и отрицательный ответ. При втором результате и наличии симптоматики, указывающей на патологию, необходимо повторить исследование. Положительный результат подтверждает диагноз и позволяет врачу начать целенаправленную терапию.
ПЦР
Одним из самых достоверных методов диагностирования энтеровирусной инфекции является ПЦР (в расшифровке – полимеразная цепная реакция). Этот способ позволяет обнаружить ДНК вирусов в мазке из ротовой полости (зева) или крови пациента. Тест помогает определить вирусоносителя и диагностировать заболевание в острой форме.
Специальная подготовка к ПЦР не требуется, однако некоторых правил все же надо придерживаться:
- Исследование следует проводить на голодный желудок. Последний прием пищи должен быть не позднее чем за 8 часов до ПЦР.
- Не рекомендуется принимать какие-либо медикаменты до проведения анализа крови на энтеровирус.
 Очень важно перед исследованием ничего не есть
Очень важно перед исследованием ничего не есть
- Необходимо отказаться от употребления спиртосодержащих напитков как минимум в течение суток до исследования. Не следует курить хотя бы час до забора материала.
- Требуется отказаться от тяжелых физических нагрузок и нервных переживаний перед диагностикой.
Не рекомендуется проводить ПЦР сразу после физиотерапии, а также инструментальных исследований. Если накануне пациенту проводилась биопсия, то необходимо сделать перерыв на два – три дня.
ИФА
Для определения антител к аденовирусам проводят специальный метод диагностики – иммуноферментный анализ. Для проведения исследования необходима венозная кровь пациента. Анализ сдается натощак, при этом предыдущий прием пищи не должен быть раньше чем за 8 часов до процедуры. Алкоголь исключается за сутки до проведения ИФА. Исследование не следует проводить после физиопроцедур или флюорографии. В противном случае результат может оказаться искаженным. Диагноз считается подтвержденным, если выявлены антитела класса IgG. Именно эти иммуноглобулины усиленно появляются в организме больного в острой фазе патологии.
 Для проведения анализа ИФА берут кровь из вены
Для проведения анализа ИФА берут кровь из вены
Используется в диагностике и дополнительная методика, получившая название парных сывороток. Этим способом выявляется острая фаза развития инфекции в первые 14 дней. При исследовании выясняется, как растет концентрация иммуноглобулинов от десятого до четырнадцатого дня. Значительное повышение показателя свидетельствует о свежей инфекции.
Выявляется IgG и в случае реактивации (восстановлении жизнеспособности) скрытой инфекции. При выздоровлении количество антител в организме снижается, но они могут остаться на всю жизнь.
Василий Бабкинский
Enterovirus, РНК [ПЦР]
Выявление вирусов рода Enterovirus (Echovirus, Сoxsackievirus, Poliovirus), в ходе которого с помощью метода полимеразной цепной реакции (ПЦР) определяется генетический материал (РНК) вируса в образце биоматериала.
Синонимы русские
Энтеровирусы, энтеровирусная инфекция .
Синонимы английские
EV, RNA .
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Кал, ликвор, мазок из зева (ротоглотки).
Как правильно подготовиться к исследованию?
- За 3-4 часа до взятия мазков из зева (ротоглотки) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
Общая информация об исследовании
Enterovirus – это группа РНК-содержащих вирусов, характеризующихся нуклеокапсидом в форме икосаэдра и отсутствием оболочки. Они относятся к семейству Picornaviridae, в которое также входят возбудитель вирусного гепатита А и риновирус.
Род Enterovirus объединяет несколько десятков различных вирусов, являющихся возбудителями целого спектра заболеваний человека: полиомиелита (Poliovirus), миокардита и перикардита (Сoxsackievirus В), вирусной пузырчатки полости рта и конечностей, герпетической ангины, асептического менингита и энцефалита (Сoxsackievirus A, Echovirus), а также более редких болезней. Для всех вирусов рода Enterovirus характерен схожий патогенез: попадание возбудителя в желудочно-кишечный тракт (фекально-оральный путь передачи), репликация в эпителиальных клетках слизистой оболочки ЖКТ и гематогенное распространение с поражением различных органов и тканей. Учитывая эти особенности заражения, основными биологическими средами для выявления Enterovirus являются отделяемое носоглотки, кал и ликвор. Как правило, острая инфекция Enterovirus протекает бессимптомно или в доброкачественной форме, а клиническая картина заболевания развивается лишь спустя некоторое время после первичного заражения. Эту особенность следует учитывать при выборе вида биоматериала, направляемого на анализ.
Для выявления возбудителя при подозрении на Enterovirus-ассоциированную инфекцию применяют серологические тесты, выделение вируса в культуре клеток и молекулярную диагностику.
Полимеразная цепная реакция (ПЦР) – это метод молекулярной диагностики, позволяющий выявлять в биологическом материале (например, в ликворе) фрагменты генетического материала (РНК) возбудителя инфекции. Она характеризуется высокой чувствительностью и специфичностью, а также позволяет получить результат в более короткие сроки по сравнению с большинством других анализов, что делает ее незаменимым инструментом для своевременной диагностики Enterovirus-ассоциированных инфекций.
ПЦР является «золотым стандартом» исследования ликвора для диагностики Enterovirus-ассоциированного менингоэнцефалита. Чувствительность такого анализа составляет 95-97 %, специфичность – 97-100 %. Благодаря этим преимуществам ПЦР заменила другой прямой метод идентификации возбудителя – выделение вируса в культуре клеток эмбриона. При этом исследование ликвора, полученного в первые 2 дня развития симптоматики менингоэнцефалита, характеризуется меньшей чувствительностью. Следует отметить, что вероятность обнаружить вирус при анализе нестерильных биологических сред (отделяемого носоглотки, кала) меньше, что необходимо учитывать при отрицательном результате анализа у пациента с клиническими признаками Enterovirus-ассоциированной инфекции. Большая частота ложноотрицательных реакций связана с полной элиминацией вируса из клеток ЖКТ к моменту развития симптомов заболевания (период репликации вируса в эпителии глотки составляет от 2 дней до 2 недель, в эпителии кишки – до 3 месяцев). Также ниже и специфичность метода при исследовании нестерильных сред, что связано с возможным «здоровым носительством» Enterovirus, сопутствующим клинически выраженному заболеванию, но не являющимся ее причиной.
ПЦР основана на непосредственном выявлении РНК вируса и может быть применена для выявления Enterovirus на раннем этапе болезни, что отличает ее от серологических (непрямых) методов, требующих около 2-4 недель для оценки динамики уровня выявляемых специфических антител. Однако по этой же причине ПЦР не позволяет различить острую и хроническую энтеровирусную инфекцию.
Благодаря тому, что в ПЦР выявляется общий для всех Enterovirus фрагмент РНК, она позволяет определить наличие любого представителя этого рода. Современные серологические методы разработаны только для 11 из более чем 70 вирусов рода Enterovirus. Однако по этой же причине с помощью ПЦР нельзя различить вирусы рода Enterovirus между собой, что имеет определенное значение в дифференциальной диагностике Enterovirus 71 – и Сoxsackievirus type A 16 – ассоциированного поражения нервной системы.
Диагностиказаболеваний, вызванных вирусами рода Enterovirus, представляет определенные трудности и требует проведения дополнительных лабораторных, а также инструментальных исследований.
Для чего используется исследование?
Для диагностики Enterovirus-ассоциированных инфекций:
- менингита;
- герпетической ангины;
- вирусной пузырчатки полости рта и конечностей;
- миоперикардита;
- полиомиелита.
Когда назначается исследование?
При симптомах:
- менингита (головная боль, раздражительность, лихорадка, фотофобия, тошнота и не приносящая облегчения рвота, ригидность затылочных мышц);
- герпетической ангины (острое начало заболевания, лихорадка с температурой 39-40 ºС, головная боль, тошнота, рвота, болезненная шейная лимфаденопатия, везикулезная сыпь на слизистой оболочке миндалин, мягкого и твердого неба, боль при глотании);
- вирусной пузырчатки полости рта и конечностей у детей (лихорадка, кашель, везикулезная сыпь на коже кистей, стоп и на слизистой оболочке рта);
- миоперикардита (одышка, загрудинная боль, усиливающаяся на вдохе и ослабевающая при наклоне вперед, а также периферические отеки и нарушения ритма сердца);
- полиомиелита (лихорадка, головная боль, тошнота, боль в животе, парез или паралич конечностей или группы мышц, нарушения глотания, пронации и др.).
Что означают результаты?
Референсные значения: отрицательно.
Положительный результат:
- Enterovirus-ассоциированная инфекция;
- носительство Enterovirus.
Отрицательный результат:
- отсутствие Enterovirus в исследуемом биоматериале.
Что может влиять на результат?
- Применение рибавирина и плеконарила может приводить к получению ложноотрицательного результата.
- Применение противовирусного иммуноглобулина не влияет на результат исследования.
- Анализ ликвора в первые 2 дня менингоэнцефалита, а также исследование отделяемого носоглотки и кала характеризуются большей частотой ложноотрицательных результатов.
Также рекомендуется
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Глюкоза в ликворе
- Белок общий в ликворе
- Креатинкиназа MB
- Креатинкиназа общая
- Cytomegalovirus предранний белок IEA, IgM, IgG
- Influenza virus A/B (вирусы гриппа А/В), РНК
- ПЦР-диагностика «клещевых» инфекций
- Полное серологическое обследование на «клещевые» инфекции
- Микроскопическое исследование мазка со слизистой оболочки носа
- Streptococcus pyogenes, ДНК
Кто назначает исследование?
Инфекционист, невролог, педиатр, стоматолог, врач общей практики.
Литература
Вирусологический метод диагностики
Прочитайте:
- A- Ручной метод
- Cовременные методы лечения миомы матки
- I. Иммунология. Определение, задачи, методы. История развитии иммунологии.
- I. Методические указания по составлению акта (заключения) судебно-психиатрической экспертизы
- I. Науково-методичне обгрунтування теми
- I. Научно-методическое обоснование темы
- I. Научно-методическое обоснование темы.
- I. ОБЩИЕ ПОЛОЖЕНИЯ МЕТОДИКИ ОБСЛЕДОВАНИЯ БОЛЬНОГО
- I. ОРГАНИЗАЦИОННО – МЕТОДИЧЕСКИЙ РАЗДЕЛ
- II) Методы исследования и симптомы поражения III, IV, VI пары ЧН
Лабораторная диагностика вирусных инфекций
Этиологическая диагностика вирусных заболеваний проводится вирусологическим, вирусоскопическим, серологическим и молекулярно-генетическим методами. Три последних метода могут быть использованы как экспресс-диагностические.
Вирусологический метод диагностики.
Конечной целью метода является идентификация вирусов до вида или серологического варианта. Вирусологический метод включает несколько этапов: 1) отбор материала для исследования; 2) обработку вируссодержащего материала; 3) заражение материалом чувствительных живых систем; 4) индикацию вирусов в живых системах; 5) титрование выделенных вирусов; 6) идентификацию вирусов в иммунных реакциях.
1. Отбор материала для исследования. Проводится в ранние сроки заболевания при соблюдении правил, предотвращающих контаминацию материала посторонней микрофлорой и инфицирование медицинского персонала. Для предупреждения инактивации вирусов при транспортировке материала, он помещается в вирусную транспортировочную среду (ВТС), состоящую из сбалансированного солевого раствора, антибиотиков и сывороточного альбумина. Транспортируется материал в специальном контейнере с термоизоляцией и закрытыми пластиковыми пакетами, содержащими лед. При необходимости материал хранят при -20˚С. Каждый образец материала для исследования должен иметь маркировку и этикетку с указанием фамилии больного, типа материала, даты его забора, развернутый клинический диагноз и другие сведения.
В зависимости от характера заболевания, материалом для исследования могут быть: 1) смывы с носовой части глотки и мазок из глотки; 2) спинномозговая жидкость; 3) кал и ректальные мазки; 4) кровь; 5) моча; 6) жидкость из серозных полостей; 7) мазок с конъюнктивы; 8) содержимое везикул; 8) секционный материал.
Для получения смыва из ротоглотки используют 15-20 мл ВТС. Больной тщательно в течение 1 минуты полощет горло ВТС и собирает смыв в стерильный флакон.
Мазок с задней стенки глотки берут стерильным ватным тампоном, надавливая на корень языка шпателем. Тампон помещают в 2-3 мл ВТС, ополаскивают и отжимают.
Спинномозговую жидкость получают при спинномозговой пункции. 1-2 мл спинномозговой жидкости помещают в стерильную посуду и доставляют в лабораторию.
Пробы кала отбирают в течение 2-3 дней в стерильные флаконы. Из полученного материала готовят 10 % суспензию с использованием раствора Хенкса. Суспензию центрифугируют при 3000 об/мин, собирают надосадочную жидкость, вносят в нее антибиотики и помещают в стерильную посуду.
Кровь, полученную при венепункции в объеме 5-10 мл, дефибринируют путем добавления гепарина. Цельную кровь не замораживают, антибиотики не добавляют. Для получения сыворотки пробы крови выдерживают в термостате при 37˚С в течение 60 минут.
Жидкость из серозных полостей получают при их пункции в количестве 1-2 мл. Жидкость используется сразу или сохраняется в замороженном состоянии.
Мазок с конъюнктивы берут стерильным тампоном и помещают в ВТС, после чего проводят центрифугирование взятого материала и его замораживание.
Содержимое везикул отсасывают шприцем с тонкой иглой и помещают в ВТС. Материал посылается в лабораторию в виде высушенных мазков на предметных стеклах или в запаянных стерильных капиллярах или ампулах.
Секционный материал отбирают в возможно ранние сроки, соблюдая правила асептики. Для отбора каждой пробы используют отдельные наборы стерильных инструментов. Количество отбираемых тканей составляет 1-3 г, которые помещают в стерильные флаконы. Вначале берут пробы внеполостных органов (мозг, лимфатические узлы и др.). Ткани грудной полости берут до вскрытия брюшной полости. Полученные образцы тканей растирают в ступке с добавлением стерильного песка и стерильного раствора натрия хлорид, после чего материал центрифугируют. Надосадочную жидкость собирают во флаконы, добавляют антибиотики. Материал для вирусологического исследования используется сразу или хранится при -20˚С.
2. Обработка вируссодержащего материала. Проводится с целью освобождения материала от сопутствующей бактериальной микрофлоры. Для этого используются физические и химические методы. Физические методы: 1) фильтрование через различные бактериальные фильтры; 2) центрифугирование. Химические методы: 1) обработка материала эфиром в случаях выделения вирусов, не имеющих суперкапсида; 2) добавление к материалу смеси гептана и фреона; 3) внесение антибиотиков (пенициллин – 200-300 ЕД/мл; стрептомицин – 200-500 мкг/мл; нистатин – 100-1000 ЕД/мл).
3. Заражение материалом чувствительных живых систем. Поскольку вирусы являются облигатными внутриклеточными паразитами, для их размножения используют следующие живые системы: 1) лабораторные животные; 2) куриные эмбрионы; 3) культуры органов; 4) культуры тканей.
Лабораторные животные. Используются белые мыши, морские свинки, хомяки, кролики и др. Белые мыши наиболее чувствительны к большому числу видов вирусов. Способ заражения животных определяется тропизмом вируса к тканям. Заражение в мозг применяется при выделении нейротропных вирусов (вирусы бешенства, полиовирусы и др.). Интраназальное заражение проводят при выделении возбудителей респираторных инфекций. Широко используются внутримышечный, внутривенный, внутрибрюшинный, подкожный и другие методы заражения. Заболевших животных усыпляют эфиром, вскрывают и производят забор материала из органов и тканей.
Куриные эмбрионы. Широко доступны и просты в работе. Применяют куриные эмбрионы в возрасте от 5 до 14 дней. Перед заражением куриные эмбрионы овоскопируют: определяют их жизнеспособность, отмечают на скорлупе границу воздушного мешка и месторасположение эмбриона («темный глаз» эмбриона). Работа с куриными эмбрионами проводится в стерильном боксе стерильными инструментами (пинцеты, шприцы, ножницы, копье и др.). После выполнения фрагмента работы инструменты погружают в 70 % этиловый спирт и перед следующей манипуляцией прожигают. Перед заражением скорлупу куриного эмбриона протирают горящим спиртовым тампоном и спиртовым раствором йода. Объем исследуемого материала, вводимого в эмбрион, составляет 0,1-0,2 мл. Для выделения вирусов из одного материала используют не менее 4 куриных эмбрионов.
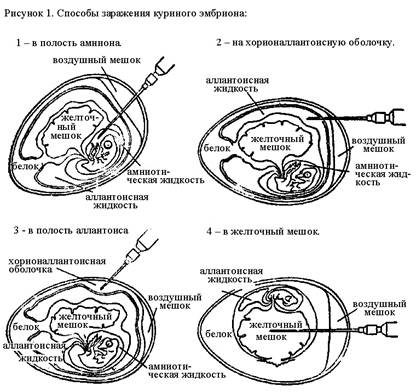 |
Существует несколько способов заражения куриного эмбриона: в полости амниона и аллантоиса, на хорион-аллантоисную оболочку, в желточный мешок (рис. 1).
Заражение в полость аллантоиса. Куриное яйцо располагают вертикально, воздушным мешком вверх. В центре тупого полюса яйца над воздушным мешком прокалывают скорлупу, вводят иглу для внутримышечных инъекций на 2-3 мм ниже границы воздушного мешка и туберкулиновым шприцем вводят исследуемый материал. Прокол в скорлупе закрывают расплавленным парафином или лейкопластырем.
Заражение в полость амниона. Над воздушным мешком вертикально расположенного яйца прорезают окно размером 1х1 см и осторожно снимают часть хорион-аллантоисной оболочки над телом эмбриона. Пинцетом вводят в него исследуемый материал с помощью туберкулинового шприца. Амниона приводят в исходное положение, отпуская пинцет. Отверстие в скорлупе закрывают лейкопластырем.
Заражение на хорион-аллантоисную оболочку. Над воздушной камерой вертикально расположенного яйца вырезают кусочек скорлупы, создавая окно. Затем отслаивают оболочку под скорлупой, обнажая участок хорион-аллантоисной оболочки, на который наносят исследуемый материал. Отверстие в скорлупе заклеивают лейкопластырем.
Заражение в желточный мешок. Яйцо укладывают горизонтально, чтобы тело эмбриона располагалось внизу, а желток над ним. Через прокол скорлупы в области воздушного мешка вводят иглу для внутримышечных инъекций по центральной оси яйца на глубину 2/3 длины иглы и шприцем вводят исследуемый материал. Отверстие в скорлупе заклеивают лейкопластырем.
После заражения эмбрионы инкубируют в термостате, располагая тупым концом кверху. Температура и продолжительность инкубации зависят от биологических свойств изолируемого вируса. По окончании инкубации эмбрионы охлаждают при +4˚С 16-18 ч. После этого куриный эмбрион стерильно вскрывают, вырезая в скорлупе отверстие над воздушным мешком выше обозначенной границы. Пастеровской пипеткой или шприцем отсасывают аллантоисную, затем амниотическую жидкость, разрезают хорион-аллантоисную оболочку для изучения, остальное содержимое яйца извлекают в чашку Петри. Аллантоисная и амниотическая жидкости используются для индикации вирусов.
Культуры органов. Это правильно приготовленные срезы органов, которые in vitro сохраняют свою структуру и функции в течение нескольких дней, а иногда и недель. Культуры органов выращивают на поверхности жидкой питательной среды с помощью «плота» или «платформы». Заражение культуры органов проводят путем внесения кусочков органа или ткани в пробирку с исследуемым материалом. Адсорбцию вируса проводят в течение 1-2 ч при комнатной температуре. Затем исследуемый материал сливают, фрагменты органа или ткани отмывают в растворе Хенкса, помещают в сосуд для культивирования, вносят питательную среду и выдерживают в термостате. Забор материала для обнаружения вируса в культуре ткани начинают со 2 дня культивирования.
Культуры клеток. Культура клеток – это популяция однотипных клеток организма животных или человека, которая выращивается в искусственных условиях и предназначается для культивирования вирусов. По длительности жизни клеточные культуры подразделяются на: 1) первичные; 2) полуперевиваемые; 3) перевиваемые.
Первичные культуры клеток получают из тканей животных и человека путём их ферментативной дезинтеграции. Кусочки ткани помещают в 0,25 % раствор трипсина при температуре 37˚С и периодически перемешивают. В результате этого происходит отделение клеток ткани друг от друга. Порции клеток собирают по мере их отделения, центрифугируют, трипсин сливают, вносят среду роста и суспендируют в ней клетки. Первичные культуры клеток могут претерпевать до 10 делений in vitro, обладают высокой чувствительностью ко многим вирусам, могут быть получены в большом количестве, безопасны в онкогенном отношении. Недостатком первичных культур является значительная трудоёмкость и длительность получения, а также возможная контаминация латентными вирусами. К первичным культурам клеток относятся клетки почки эмбриона человека, макаки резус, эмбриона свиньи, фибробласты куриных эмбрионов.
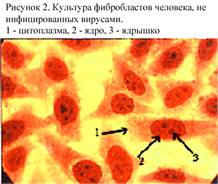 Полуперевиваемые культуры клеток представляют собой диплоидные клетки одного типа, которые способны претерпевать in vitro до 100 делений, сохраняя при этом исходный диплоидный набор хромосом. К полуперевиваемым культурам клеток относятся фибробласты эмбриона человека (рис. 2). Эти клетки чрезвычайно требовательны к условиям культивирования, поэтому в практике вирусологических лабораторий имеют ограниченное применение.
Полуперевиваемые культуры клеток представляют собой диплоидные клетки одного типа, которые способны претерпевать in vitro до 100 делений, сохраняя при этом исходный диплоидный набор хромосом. К полуперевиваемым культурам клеток относятся фибробласты эмбриона человека (рис. 2). Эти клетки чрезвычайно требовательны к условиям культивирования, поэтому в практике вирусологических лабораторий имеют ограниченное применение.
Перевиваемые культуры клеток – это однотипные опухолевые или нормальные клетки человека и животных с изменённым кариотипом, способные к неограниченному росту в условиях in vitro. Перевиваемые культуры клеток просты при культивировании, в связи с чем широко используются при лабораторной диагностике вирусных заболеваний у человека. К перевиваемым культурам клеток относятся линии НеLа (клетки карциномы шейки матки человека), КВ (клетки карциномы полости рта человека), Vero (клетки почки зеленой мартышки), СПЭВ (клетки почки эмбриона свиньи) и др.
Выращивание культур клеток независимо от их типа проводится в стерильных условиях в специальных плоских стеклянных сосудах – матрацах, в которые вносится питательная среда. На дне матраца клетки при своем размножении образуют монослой.
Для культивирования культур клеток используются специальные питательные среды, содержащие физиологические количества аминокислот, углеводов, минеральных солей, и имеющие рН=7,2-7,4. Наряду с питательными веществами в средах имеется индикатор, изменяющий цвет среды при сдвиге рН от оптимального значения. Наиболее широко используемыми при работе с культурами клеток являются: среда 199, среда Игла. Среда 199 включает 60 компонентов и применяется для культивирования перевиваемых и первично-трипсинизированных клеток. Среда Игла содержит минимальный набор аминокислот (13) и витаминов (8). Применяется для культивирования диплоидных и перевиваемых клеточных культур.
Выращивание клеток должно проводится в асептических условиях, в связи с чем в питательные среды вносят антибиотики (например, пенициллин и стрептомицин).
4. Индикация вирусов в живых системах.Индикация вирусов – это обнаружение вирусов в исследуемом материале без установления их принадлежности к семейству, роду, виду или сероварианту.
Индикация вирусов на лабораторных животных. О присутствии вирусов в организме прежде всего свидетельствует развитие симптомов заболевания или гибель животного. У погибшего или предварительно усыпленного эфиром животного отбирают образцы пораженных органов и тканей, помещают их в фарфоровую ступку, добавляют солевой раствор и растирают с песком. Полученную суспензию центрифугируют для осаждения тканевого детрита. В надосадочной жидкости проводят индикацию вирусов по гемагглютинирующему, комплементсвязывающему или другим антигенам.
Индикация вирусов на куриных эмбрионах. В амниотической и аллантоисной жидкости индикацию вирусов осуществляют в реакции гемагглютинации (РГА). При заражении куриного эмбриона на хорион-аллантоисную оболочку нередко обнаруживаются бляшки или оспины, являющиеся вирусоспецифическими повреждениями. Индикацию вирусов в хорион-аллантоисной оболочке проводят в реакциях гемагглютинации или связывания комплемента (РСК). Для этого оболочку растирают в ступке, готовят суспензию, которую центрифугируют для осаждения тканевого детрита, а надосадочную жидкость исследуют в РГА или РСК.
Индикация вирусов в культурах органов и клеток проводится по: 1) цитопатическому действию вирусов (ЦПД); 2) образованию внутриклеточных включений; 3) в реакции гемагглютинации; 4) по образованию бляшки; 5) по цветной пробе; 6) по реакции гемадсорбции.
ЦПД – это морфологические изменения в культуре органов и клеток, возникающие в процессе репродукции вирусов в клетках. Вирусы, вызывающие ЦПД, называют цитопатогенными. Характер ЦПД зависит от биологических свойств вирусов, дозы вируса, свойств клеток и условий их культивирования. ЦПД вирусов может проявляться некрозом, гроздьеобразованием, симпласто- и синцитиеобразованием, круглоклеточной дегенерацией, клеточной пролиферацией, очаговой деструкцией.
 При некротическом ЦПД вирусов полиомиелита, Коксаки, ЕСНО большинство клеток полностью разрушается, оставшиеся клетки сморщены (пикноз ядра и цитоплазматической мембраны, вакуолизация), для них характерно двойное лучепреломление – сильное свечение при микроскопии.
При некротическом ЦПД вирусов полиомиелита, Коксаки, ЕСНО большинство клеток полностью разрушается, оставшиеся клетки сморщены (пикноз ядра и цитоплазматической мембраны, вакуолизация), для них характерно двойное лучепреломление – сильное свечение при микроскопии.
ЦПД по типу гроздьеобразования характерно для аденовирусов, при этом клетки округляются, увеличиваются, частично сливаются между собой с образованием гроздьевидных скоплений (рис. 3).
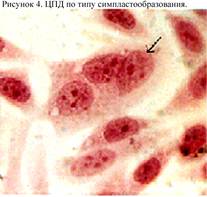
Вирусы герпеса, кори, паротита, парагриппа, РС-вирусы вызывают ЦПД по типу симпласто- или синцитиеобразования (рис. 4).
Синцитий состоит из клеток, соединенных цитоплазматическими мостиками, тогда как симпласт – это большая многоядерная клетка, образовавшаяся в результате многократных незавершённых митозов.
ЦПД вирусов по типу круглоклеточной дегенерации характеризуется округлением клеток и утратой ими межклеточных связей. Может наблюдаться также пикноз, сморщивание и деструкция клеток (рис. 5).
У онкогенных вирусов ЦПД может проявиться трансформацией клеток в злокачественные, что сопровождается интенсивной пролиферацией клеток и образованием многослойных клеточных структур. ЦПД некоторых штаммов вирусов гриппа, осповакцины, натуральной оспы проявляется очаговой деструкцией культуры клеток – на фоне сохранившегося в целом монослоя появляются очаги поражения клеток (микробляшки).
 При отсутствии или слабо выраженном ЦПД проводят заражение культуральной жидкостью новых культур клеток.
При отсутствии или слабо выраженном ЦПД проводят заражение культуральной жидкостью новых культур клеток.

 Внутриклеточные включения в цитоплазме или ядре клетки образуются при репродукции в них вирусов бешенства, оспы, гриппа, герпеса, аденовирусов и др. Внутриклеточные включения представляют собой кристалловидные скопления вирионов. Включения обнаруживают при световой иммерсионной микроскопии после окраски стекол с монослоем по Романовскому-Гимзе, или при люминесцентной микроскопии после обработки акридиновым оранжевым. При окраске по Романовскому-Гимзе вирусные включения приобретают розовый или розово-сиреневый цвет. При окраске акридиновым оранжевым ДНК-структуры дают зеленое свечение, а РНК-структуры – красновато-оранжевое. В настоящее время выявление внутриклеточных включений проводят при диагностике бешенства (тельца Бабеша-Негри) (рис. 6). Ранее при натуральной оспе проводилось выявление телец Гварнери.
Внутриклеточные включения в цитоплазме или ядре клетки образуются при репродукции в них вирусов бешенства, оспы, гриппа, герпеса, аденовирусов и др. Внутриклеточные включения представляют собой кристалловидные скопления вирионов. Включения обнаруживают при световой иммерсионной микроскопии после окраски стекол с монослоем по Романовскому-Гимзе, или при люминесцентной микроскопии после обработки акридиновым оранжевым. При окраске по Романовскому-Гимзе вирусные включения приобретают розовый или розово-сиреневый цвет. При окраске акридиновым оранжевым ДНК-структуры дают зеленое свечение, а РНК-структуры – красновато-оранжевое. В настоящее время выявление внутриклеточных включений проводят при диагностике бешенства (тельца Бабеша-Негри) (рис. 6). Ранее при натуральной оспе проводилось выявление телец Гварнери.
Образование бляшек. Бляшки – это очаги разрушенных первично инфицированных вирусом клеток монослоя, находящегося под агаровым покрытием. Бляшки выявляются путём окрашивания культуры нейтральным красным, который либо включают в состав агарового покрытия, либо добавляют непосредственно перед учётом результатов. Поскольку бляшки состоят из погибших клеток, не воспринимающих краситель, поэтому они видны в виде светлых пятен на фоне розово-красного монослоя живых клеток. Учёт бляшкообразования проводят для количественного анализа инфекционной активности клеток.
Цветная проба. Среды 199 и Игла, в которых культивируют культуры клеток, имеют малиновый цвет, рН=7,2-7,4 и содержат индикатор, меняющий окраску среды при изменении рН. При культивировании в этих средах клеточных культур, не инфицированных вирусом, вследствие выделения клетками кислых продуктов метаболизма цвет среды изменяется на оранжевый. Вирусинфицированные клетки в результате подавления метаболизма вирусной репродукцией, а также в результате ЦПД вирусов, разрушаются, щелочная цитоплазма клеток попадает в среду, не изменяя её цвета (среда остаётся красной).
Реакция гемагглютинации (РГА) основана на способности некоторых вирусов, содержащих на своей внешней оболочке агглютинин, склеивать (агглютинировать) эритроциты определенных видов животных. Для проведения РГА используют бесклеточный вируссодержащий материал (аллантоисную или амниотическую жидкость, супернатант тканевых культур). Вируссодержащую жидкость смешивают с 0,5 мл изотонического раствора натрия хлорида и 0,5 мл 1 % взвеси отмытых эритроцитов, после чего инкубируют при 37˚, 20˚ или 4˚С в течение 30-60 минут. При отрицательном контроле развитие агглютинации в опыте свидетельствует о присутствии вируса в исследуемой жидкости. Контролем служит смесь 0,5 мл эритроцитов с равным объемом изотонического раствора натрия хлорида, не содержащего вирус.
 Реакция гемадсорбции (РГадс) позволяет обнаружить гемагглютининсодержащие вирусы в клеточных культурах до развития ЦПД (рис. 7). Гемадсорбция наблюдается только в том случае, если гемагглютинин вируса присутствует на цитоплазматической мембране клеток культуры. Ргадс проводится путём внесения в клеточную культуру 0,2 мл 0,5 % взвеси эритроцитов, после чего клетки выдерживают 15-20 минут при 37˚, 20˚ или 4˚С (в зависимости от свойств вируса). Затем пробирки встряхивают для удаления неадсорбированных эритроцитов и учитывают под малым увеличением микроскопа скопление их на отдельных клетках или на всем монослое. На неинфицированных вирусами клетках адсорбции эритроцитов не наблюдается.
Реакция гемадсорбции (РГадс) позволяет обнаружить гемагглютининсодержащие вирусы в клеточных культурах до развития ЦПД (рис. 7). Гемадсорбция наблюдается только в том случае, если гемагглютинин вируса присутствует на цитоплазматической мембране клеток культуры. Ргадс проводится путём внесения в клеточную культуру 0,2 мл 0,5 % взвеси эритроцитов, после чего клетки выдерживают 15-20 минут при 37˚, 20˚ или 4˚С (в зависимости от свойств вируса). Затем пробирки встряхивают для удаления неадсорбированных эритроцитов и учитывают под малым увеличением микроскопа скопление их на отдельных клетках или на всем монослое. На неинфицированных вирусами клетках адсорбции эритроцитов не наблюдается.
5. Титрование выделенных вирусов -это обязательный этап вирусологического метода диагностики, целью которого является количественное определение содержания вирусных частиц в единице объема исследуемого материала.
Методы титрования вирусов, выделенных на лабораторных животных предусматривают определение дозы (титра), при которой возбудитель вызывает гибель 50 % инфицированных животных или характерные симптомы заболевания. Титр вирусов выражают в ЛД50 – летальная доза или в ИД50 – инфицирующая доза.
Титрование вирусов, выделенных на куриных эмбрионах и обладающих гемагглютинирующей активностью проводят в реакции гемагглютинации. РГА проводят в пробирках или в специальных планшетах. Из вируссодержащего материала готовят двукратные разведения в 0,5 мл изотонического раствора натрия хлорид. Во все пробирки добавляют 0,5 мл взвеси эритроцитов. Контролем служит смесь 0,5 мл эритроцитов с таким же объемом изотонического раствора натрия хлорида, не содержащего вирусов. В зависимости от свойств изучаемого вируса инкубацию смеси проводят в термостате при 37˚, 20˚ и 4˚С. Результаты реакции учитывают через 30-60 минут после полного оседания эритроцитов в контроле: (++++) – интенсивная и быстрая агглютинация эритроцитов, осадок имеет звездчатую форму с фестончатыми краями («зонтик»); (+++) – осадок эритроцитов имеет просветы; (++) – менее выраженный осадок; (+) – хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов и (-) – резко очерченный осадок эритроцитов («монетный столбик»), такой же, как в контроле. Титром вируса при проведении РГА называется наибольшее его разведение, при котором еще наблюдается агглютинация эритроцитов. Это разведение считают содержащим одну гемагглютинирующую единицу вируса (1 ГАЕ). Разведения, которые предшествуют 1 ГАЕ, будут содержать в 2 раза больше ГАЕ по сравнению с последующим от них разведением. Например, если 1 ГАЕ соответствует разведению 1:64, то разведение 1:32 будет соответствовать 2 ГАЕ, а разведения 1:16 и 1:8 – 4 и 8 ГАЕ соответственно. Для идентификации вирусов, как правило, используется титр вируса, равный 4 ГАЕ.
Титрование вирусов в культурах клеток проводят по ЦПД, бляшкообразованию и цветной пробе.
Титром вируса при его определении в культурах клеток по ЦПД называется то наибольшее разведение вируссодержащего материала, в котором вирус способен вызвать ЦПД у 50 % инфицированных культур клеток. Эта величина называется 50 % тканевой цитопатической дозой (ТЦД50). Титрование вируса по ЦПД включает следующие этапы: 1) посев, выращивание и отбор пробирочных культур клеток, имеющих сформировавшийся монослой; 2) получение 10-кратных разведений вируссодержащего материала; 3) инфицирование культур клеток разными разведениями вируса; 4) выдерживание –культур клеток в термостате при 37˚; 5) учет результатов на 5-7 сутки по системе плюсов (++++) и статистическую обработку результатов. Для получения статистически достоверных результатов необходимо соблюдение ряда правил: а) использование не менее 4 пробирочных культур клеток для заражения 1 разведением вируса; б) включение в титровальный ряд 2 разведений вируса – ниже и выше ЦПД50.
Титрование вирусов в культурах клеток по бляшкообразованию является одним из наиболее чувствительных и точных методов количественного определения вирусов. Вместе с тем, метод технически сложен и, в основном, используется при проведении научных исследований.
Титрование вирусов в культурах клеток методом цветной пробы призвано определить наибольшее разведение вируссодержащего материала, при котором происходит изменение цвета среды, содержащей суспензию клеток в концентрации 200 тысяч клеток в 1 мл. После установления титра вируса готовят рабочую дозу – 100 ТЦД50, которую используют при идентификации вирусов.
6. Идентификация вирусов в иммунных реакциях. Идентификация, или титрование вирусов – это установление их вариантной, видовой, родовой и семейственной принадлежности. Идентификация вирусов проводится по принципу: определение неизвестного по известному. Известным компонентом при идентификации вирусов являются специфические противовирусные сыворотки (противогриппозные, противокоревые и др.), которые используют в серологических реакциях нейтрализации (РН), торможения гемадсорбции (РТГадс), торможения гемагглютинации (РТГА), РПГА, РСК, а также при ИФА и РИА. Эти сыворотки содержат специфические противовирусные антитела и называются диагностическими.
Реакция нейтрализации (РН) может быть проведена на культуре клеток, куриных эмбрионах и животных. В пробирках готовят нейтрализационные смеси, состоящие из равных объемов вируссодержащего материала (обычно 100 ТЦД50 вируса в 1,0 мл) и диагностической сыворотки (1,0 мл). После тщательного встряхивания приготовленные смеси выдерживают для взаимодействия в течение 3 ч при 37˚С. Затем нейтрализационные смеси вносят в чувствительную клеточную культуру, которую инкубируют при 37˚С 5-7 суток, после чего учитывают результаты по ЦПД и цветной пробе (табл. 1).
Вирусологические методы исследования
Вирусологи́ческие методы исследования
Методы изучения биологии вирусов и их идентификации. В вирусологии широко используются методы молекулярной биологии, с помощью которых удалось установить молекулярную структуру вирусных частиц, способы проникновения их в клетку и особенности репродукции вирусов, первичной структуры вирусных нуклеиновых кислот и белков. Развиваются методы определения последовательности составляющих элементов вирусных нуклеиновых кислот и аминокислот белка. Появляется возможность связать функции нуклеиновых кислот и кодируемых ими белков с последовательностью нуклеотидов и установить причины внутриклеточных процессов, играющих важную роль в патогенезе вирусной инфекции.
Вирусологические методы исследования основаны также на иммунологических процессах (взаимодействие антигена с антителами), биологических свойствах вируса (способность к гемагглютинации, гемолизу, ферментативная активность), особенностях взаимодействия вируса с клеткой-хозяином (характер цитопатического эффекта, образование внутриклеточных включений и т.д.).
В диагностике вирусных инфекций, при культивировании, выделении и идентификации вирусов, а также при получении вакцинных препаратов широко применяют метод культуры ткани и клеток. Используют первичные, вторичные, стабильные перевиваемые и диплоидные клеточные культуры. Первичные культуры получают при диспергировании ткани протеолитическими ферментами (трипсином, коллагеназой). Источником клеток могут быть ткани и органы (чаще почки) эмбрионов человека и животных. Суспензию клеток в питательной среде помещают в так называемые матрацы, бутыли или чашки Петри, где после прикрепления к поверхности сосуда клетки начинают размножаться. Для заражения вирусами используют обычно клеточный монослой. Питательную жидкость сливают, вносят вирусную суспензию в определенных разведениях и после контакта с клетками добавляют свежую питательную среду, обычно без сыворотки.
Клетки большинства первичных культур могут быть пересеяны, такая культура называется вторичной. При дальнейшем пассировании клеток формируется популяция фибробластоподобных клеток, способных к быстрому размножению, большая часть которых сохраняет исходный набор хромосом. Это так называемые диплоидные клетки. При серийном культивировании клеток получают стабильные перевиваемые клеточные культуры. При пассажах появляются быстро делящиеся однородные клетки с гетероплоидным набором хромосом. Стабильные линии клеток могут быть однослойными и суспензионными. Однослойные культуры растут в виде сплошного слоя на поверхности стекла, суспензионные — в виде суспензий в различных сосудах с использованием перемешивающих устройств. Существует более 400 линий клеток, полученных от 40 различных видов животных (в т.ч. от приматов, птиц, рептилий, амфибий, рыб, насекомых) и человека.
В искусственных питательных средах можно культивировать кусочки отдельных органов и тканей (органные культуры). Эти типы культур сохраняют структуру ткани, что особенно важно для выделения и пассирования вирусов, которые не репродуцируются в недифференцированных тканевых культурах (например, коронавирусы).
В зараженных клеточных культурах вирусы можно обнаружить по изменению морфологии клеток, цитопатическому действию, которое может иметь специфический характер, появлению включений, путем определения вирусных антигенов в клетке и в культуральной жидкости; установления биологических свойств вирусного потомства в культуральной жидкости и титрования вирусов в культуре ткани, куриных эмбрионах или на чувствительных животных; путем выявления отдельных вирусных нуклеиновых кислот в клетках методом молекулярной гибридизации или скоплений нуклеиновых кислот цитохимическим методом с помощью люминесцентной микроскопии.
Выделение вирусов является трудоемким и длительным процессом. Его осуществляют с целью определения циркулирующего среди населения типа или варианта вируса (например, для идентификации сероварианта вируса гриппа, дикого или вакцинного штамма вируса полиомиелита и т.д.); в случаях, когда это необходимо для проведения срочных эпидемиологических мероприятий; при появлении новых типов или вариантов вирусов; при необходимости подтверждения предварительного диагноза; для индикации вирусов в объектах окружающей среды. При выделении вирусов учитывают возможность их персистирования в организме человека, а также возникновения смешанной инфекции, вызванной двумя и более вирусами. Генетически однородная популяция вируса, полученная от одного вириона, называется вирусным клоном, а сам процесс получения его — клонированием.
Для выделения вирусов применяют заражение восприимчивых лабораторных животных, куриных эмбрионов, но чаще всего используют культуру ткани. Наличие вируса обычно определяют по специфической дегенерации клеток (цитопатический эффект), образованию симпластов и синцитиев, обнаружению внутриклеточных включений, а также специфического антигена, выявляемого с помощью методов иммунофлюоресценции, гемадсорбции, гемагглютинации (у гемагглютинирующих вирусов) и т.д. Эти признаки могут обнаруживаться лишь после 2—3 пассажей вируса.
Для выделения ряда вирусов, например вирусов гриппа, используют куриные эмбрионы, для выделения некоторых вирусов Коксаки и ряда арбовирусов — новорожденных мышей. Идентификацию выделенных вирусов проводят с помощью серологических реакций и других методов.
При работе с вирусами определяют их титр. Титрование вирусов проводят обычно в культуре ткани, определяя наибольшее разведение вируссодержащей жидкости, при котором происходит дегенерация ткани, образуются включения и вирусоспецифические антигены. Для титрования ряда вирусов можно использовать метод бляшек. Бляшки, или негативные колонии вирусов, представляют собой очаги разрушенных под действием вируса клеток однослойной культуры ткани под агаровым покрытием. Подсчет колоний позволяет провести количественный анализ инфекционной активности вирусов из расчета, что одна инфекционная частица вируса образует одну бляшку. Бляшки выявляют путем окрашивания культуры прижизненными красителями, обычно нейтральным красным; бляшки не адсорбируют краситель и поэтому видны как светлые пятна на фоне окрашенных живых клеток. Титр вируса выражают числом бляшкообразующих единиц в 1 мл.
Очистку и концентрацию вирусов обычно осуществляют путем дифференциального ультрацентрифугирования с последующим центрифугированием в градиентах концентраций или плотности. Для очистки вирусов применяют иммунологические методы, ионно-обменную хроматографию, иммуносорбенты и т.д.
Лабораторная диагностика вирусных инфекций включает обнаружение возбудителя или его компонентов в клиническом материале; выделение вируса из этого материала; серодиагностику. Выбор метода лабораторной диагностики в каждом отдельном случае зависит от характера заболевания, периода болезни и возможностей лаборатории. Современная диагностика вирусных инфекций основана на экспресс-методах, позволяющих получать ответ через несколько часов после взятия клинического материала в ранние сроки после заболевания, К ним относятся электронная и иммунная электронная микроскопия, а также иммунофлюоресценция, метод молекулярной гибридизации, выявление антител класса lgM и др.
Электронная микроскопия вирусов, окрашенных методом негативного контрастирования, позволяет дифференцировать вирусы и определять их концентрацию. Применение электронной микроскопии в диагностике вирусных инфекций ограничивается теми случаями, когда концентрация вирусных частиц в клиническом материале достаточно высокая (105 в 1 мл и выше). Недостатком метода является невозможность отличать вирусы, принадлежащие к одной таксономической группе. Этот недостаток устраняется путем использования иммунной электронной микроскопии. Метод основан на образовании иммунных комплексов при добавлении специфической сыворотки к вирусным частицам, при этом происходит одновременная концентрация вирусных частиц, позволяющая идентифицировать их. Метод применяют также для выявления антител. В целях экспресс-диагностики проводят электронно-микроскопическое исследование экстрактов тканей, фекалий, жидкости из везикул, секретов из носоглотки. Электронную микроскопию широко используют для изучения морфогенеза вируса, ее возможности расширяются при применении меченых антител.
Метод молекулярной гибридизации, основанный на выявлении вирусоспецифических нуклеиновых кислот, позволяет обнаружить единичные копии генов и по степени чувствительности не имеет себе равных. Реакция основана на гибридизации комплементарных нитей ДНК или РНК (зондов) и формировании двунитчатых структур. Наиболее дешевым зондом является клонированная рекомбинантная ДНК. Зонд метят радиоактивными предшественниками (обычно радиоактивным фосфором). Перспективно использование колориметрических реакций. Существует несколько вариантов молекулярной гибридизации: точечная, блот-гибридизация, сэндвич-гибридизация, гибридизация in situ и др.
Антитела класса lgM появляются раньше, чем антитела класса G (на 3—5-й день болезни) и исчезают через несколько недель, поэтому их обнаружение свидетельствует о только что перенесенной инфекции. Антитела класса lgM выявляют методом иммунофлюоресценции или с помощью иммуноферментного анализа, используя анти- μ-антисыворотки (сыворотки против тяжелых цепей lgM).
Серологические методы в вирусологии основаны на классических иммунологических реакциях (см. Иммунологические методы исследования): реакции связывания комплемента, торможения гемагглютинации, биологической нейтрализации, иммунодиффузии, непрямой гемагглютинации, радиального гемолиза, иммунофлюоресценции, иммуноферментного, радиоиммунного анализа. Разработаны микрометоды многих реакций, техника их непрерывно совершенствуются. Эти методы используют для идентификации вирусов с помощью набора известных сывороток и для серодиагностики с целью определения нарастания антител во второй сыворотке по сравнению с первой (первую сыворотку берут в первые дни после заболевания, вторую — через 2—3 нед.). Диагностическое значение имеет не менее чем четырехкратное нарастание антител во второй сыворотке. Если выявление антител класса lgM свидетельствует о недавно перенесенной инфекции, то антитела класса lgC сохраняются в течение нескольких лет, а иногда и пожизненно.
Для идентификации индивидуальных антигенов вирусов и антител к ним в сложных смесях без предварительной очистки белков используют иммуноблоттинг. Метод сочетает фракционирование белков с помощью электрофореза в полиакриламидном геле с последующей иммуноиндикацией белков иммуноферментным методом. Разделение белков снижает требования к химической чистоте антигена и позволяет выявлять индивидуальные пары антиген — антитело. Такая задача актуальна, например, при серодиагностике ВИЧ-инфекции, где ложноположительные реакции иммуноферментного анализа обусловлены наличием антител к клеточным антигенам, которые присутствуют в результате недостаточной очистки вирусных белков. Идентификация антител в сыворотках больных к внутренним и наружным вирусным антигенам позволяет определять стадию заболевания, а при анализе популяций — изменчивость вирусных белков. Иммуноблоттинг при ВИЧ-инфекции применяют как подтверждающий тест для выявления индивидуальных вирусных антигенов и антител к ним. При анализе популяций метод используют для определения изменчивости вирусных белков. Большая ценность метода заключается в возможности анализа антигенов, синтезируемых с помощью технологии рекомбинантных ДНК, установлении их размеров и наличия антигенных детерминант.
Библиогр.: Букринская А.Г. Вирусология, М., 1986; Вирусология, Методы, под ред. Б. Мейхи, пер. с англ., М., 1988; Справочник по микробиологическим и вирусологическим методам исследования, под ред. М.О. Биргера, М., 1982.
Источник: Медицинская энциклопедия на Gufo.me
Вопрос 17. Методы микробиологической диагностики вирусных инфекций.
1.Вирусоскопический — обнаружение в исследуемом материале с помощью методов электронной микроскопии вирионов или с помощью светооптических микроскопов внутриклеточных включений.
2.Обнаружение вирусов с помощью методов иммуноэлектронной микроскопии.
3.Вирусологические методы — выделение чистых культур вирусов с использованием культур клеток или куриных эмбрионов.
4.Серологические методы — обнаружение противовирусных антител в сыворотке больного или реконвалесцента с помощью реакций нейтрализации вирусов, реакции связывания комплемента, реакции торможения гемагглютинации, реакций иммуноферментного метода (ИФМ), радиоиммунного метода, (РИМ), реакции пассивной гемагглютинации (РПГА), реакции гемагглютинации иммунного прилипания (комплекс АГ+АТ в присутствии комплемента адсорбируется на эритроцитах),реакций преципитации в агаре, имлунофлуоресцентного метода. В принципе эти реакции могут быть использованы и для обнаружения вирусных антигенов.
5.Биологические методы — заражение чувствительных к данному вирусу лабораторных животных с целью воспроизведения заболевания или последующего выделения вируса.
Вопрос 18. Что такое вирусоскопический метод диагностики?
Вирусоскопический — обнаружение в исследуемом материале с помощью методов электронной микроскопии вирионов или с помощью светооптических микроскопов внутриклеточных включений.
Вопрос 19. Что такое вирусологический метод диагностики?
Вирусологические методы — выделение чистых культур вирусов с использованием культур клеток или куриных эмбрионов.
Вопрос№20 Типы вирусных инфекций
1) инфекции с непродолжительным пребыванием вируса в организме (острая продуктивная инфекция; инаппарантная, бессимптомная инфекция);
2) инфекции с длительным пребыванием (персистенцией) вируса в организме (персистентная, латентная, хроническая, медленная инфекция).
Вопрос№21особенности и механизмы противовирусного иммунитета.
Противовирусный иммунитет включает 3 независимых механизма:
1) вируснейтрализующие антитела, т.е. антитела, блокирующие те рецепторы вируса, с помощью которых он прикрепляется к рецепторам клеток — мишеней (прикрепление вируса к клетке — главный пусковой механизм развития вирусной инфекции); однако этот механизм формируется после перенесенной инфекции, т.е. он в основном — направлен против повторного заражения
2)Т-киллеры распознают чужеродный (вирусный) антиген лишь в том случае, если он представлен белками МНС класса I. Т-киллеры распознают их своими рецепторами, атакуют и уничтожают инфицированную клетку вместе с вирусом.
3)три типа интерферонов (α, β, γ),которые наряду с противоопухолевым, иммуномодулирующим, антибактериальным обладают и широким спектром противовирусного действия. Интерферон не действует непосредственно на вирус и не препятствует проникновению его в клетку. Интерферон блокирует внутриклеточное размножение вируса. Антивирусная активность интерферонов может быть реализована с помощью разных механизмов, в зависимости, очевидно, от типа клеток, в которые проникает вирус, и от типа интерферона. Один из механизмов такого действия заключается в том, что он индуцирует синтез протеинкиназы, которая фосфорилизует α-субъединицу белкового фактора инициации eIF2 . В результате этого блокируется обменная реакция ГДФ -ГТФ и происходит остановка биосинтеза белка на стадии инициации трансляции. В иных случаях под влиянием интерферона активируется эндонуклеаза, разрушающая РНК, в том числе и мРНК.
Вопрос№22механизмы персистирования вирусов в организмеПерсистенция (лат. persisto — постоянно пребывать, оставаться) — длительное пребывание инфекта в организме животных и человека либо без клинических патологических проявлений (латентное течение, ремиссия инфекционного процесса), либо способных при определенных условиях (иммунный дисбаланс и иммунная недостаточность различной этиологии — стресс, переохлаждение, интеркуррентная инфекция, обстрение хронического заболевания и т.д.) к активации с исходом в заболевание (активное течение, обострение инфекционного процесса). В механизме развития и активации персистирующей инфекции значительная роль отводится блокированию процессов апоптоза клеток хозяина.В группу патогенов, способных к персистирующему течению, относят возбудителей инфекции, в большей части обладающих свойствами внутриклеточного существования в макрорганизме. Это некоторые бактерии (хламидии, микоплазмы, хеликобактер и др.), но главным образом — вирусы (группа герпесвирусов, гепатита, ВИЧ и многие другие), токсоплазмы и др. Вызываемый ими инфекционный процесс развивается медленно, возбудитель стремится быть не узнанным иммунной системой и сохранить себя в человеческих популяциях, интегрируясь с геномом человека (ретровирусы, герпесвирусы, вирус гепатита В, С, хламидии, микоплазмы, токсоплазмы и др.), либо как плазменное образование. Продолжительность таких инфекционных процессов не лимитируется иммунной системой хозяина. Эпидемическая цепочка ограничивается лишь количеством человеческих особей в популяции, поэтому распространение некоторых паразитических микроорганизмов приобрело характер пандемии (ВИЧ, вирус гепатита В, некоторые виды вирусов герпеса, хламидии, микоплазмы).
Методы лабораторной диагностики вирусных инфекций
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
— Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
— Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики — выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

— Отмывают не связавшиеся антитела и антигены.
— Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.
Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.
Если стоит задача выявления антител, то сделать это возможно при помощи реакции торможения гемагглютинации (РТГА). В лунку с вирусом и эритроцитами закапывают различные пробы. При наличии антител они свяжут вирус, и эритроциты упадут на дно с образованием «пуговки».
Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
— Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
— Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
— Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.
Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.
При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса — возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.