Содержание
- Бруцеллы
- Бруцеллез
- Постановка реакции агглютинации (реакция Райта) на бруцеллез
- РЕАКЦИИ АГГЛЮТИНАЦИИ
- АГГЛЮТИНАЦИЯ
- Райта реакция
- Реакция Райта
- Особенности проведения реакции
- Результаты реакции Райта
- Реакция Хеддельсона
- Метод осуществления реакции Хеддельсона
- Зачем может понадобиться купить анализы?
- РАЙТА РЕАКЦИЯ
>Бруцеллы и бруцеллез
Бруцеллы
Названы в честь Д. Брюса. Патогенными для человека являются три вида бруцелл: В. melitensis — возбудитель бруцеллеза мелкого рогатого скота, В. abortus — возбудитель бруцеллеза крупного рогатого скота, В. suis — возбудитель бруцеллеза свиней. Все три вида бруцелл патогенны для человека.
Морфология и физиология
Бруцеллы — мелкие коккобактериальные грамотрицательные бактерии. Они не образуют спор, лишены жгутиков и имеют капсулу. Бруцеллы требовательны к питательным средам. Они нуждаются в нативном белке или в аминокислотах и других факторах роста. Размножаются медленно, особенно в первых генерациях.
Патогенность и патогенез
Факторами вирулентности бруцелл являются капсула, способность к инвазии, устойчивость к бактерицидному действию крови, секреция ферментов (гиалуронидаза и др.), которые способствуют их распространению в тканях. Бруцеллы множественными путями проникают в организм хозяина. Затем благодаря выраженной инвазивности попадают в лимфу и кровь, вызывая бактериемию. С кровью они разносятся по организму, проникают и размножаются в лимфоидных клетках, образуя гранулемы в печени, селезенке, лимфоузлах. Высокая инвазивность бруцелл, вероятно, связана с гиалуронидазой и другими ферментами. При разрушении бруцелл освобождается эндотоксин, вызывая присущие ему патологические явления. Хронический метастатический характер бруцеллезной инфекции проявляется поражением кроветворной, нервной, половой системы. У беременных возникают инфекционные аборты. Бруцеллы способны персистировать в лимфоидной ткани в течение длительных сроков. Периодические обострения инфекции связаны с их размножением и поступлением в кровь.Однако в крови бруцеллы не размножаются.
Иммунитет
При бруцеллезе формируется напряженный гуморальный и клеточный постинфекционный иммунитет. Первый проявляется в антителообразовании: в сыворотке крови накапливаются агглютинины (вначале IgM, затем IgG) и опсонизирующие антитела, обладающие протективными свойствами. Клеточный иммунитет проявляется в аллергии замедленного типа (ГЗТ), которая выявляется с помощью кожно-аллергической пробы с бруцеллином, а также в реакции бласттрансформации лимфоцитов и торможении миграции макрофагов. Повторные заболевания практически не встречаются.
Экология и эпидемиология
Бруцеллез является типично зооноз-ной инфекцией. Человек заражается только от больных животных через мясо, молоко, брынзу, масло. Во многих случаях заболевание носит профессиональный характер, поскольку наиболее часто болеют люди, работающие со скотом. Бруцеллы устойчивы к факторам окружающей среды. Они месяцами сохраняются в моче, навозе больных животных, в шерсти овец, в пыли. Хорошо переносят низкие температуры: в замороженном мясе сохраняются до полугода. Высокочувствительны к дезинфектантам и повышенным температурам.
Бруцеллез
Бруцеллез — хроническая или остро-хроническое зоонозная инфекционная болезнь с рецидивирующим долговременным течением, ундулюючою лихорадкой, преимущественным поражением опорно-двигательных органов, нервной и мочеполовой системы. Возбудителями его являются несколько видов бактерий, объединенных в род Brucella: B.melitensisy В.abortus, B.suis, B.ovis, B.canis, B.neotomae.Из всех видов наиболее патогенной для человека B.melitensis. Она вызывает 95-97% всех случаев бруцеллеза, на долю В. abortus приходится 1-3%, еще реже заболевание вызывает B.suis (менее 1%). Позже от баранов, больных эпидидимит, выделили В. ovis, от кустарниковых крыс — B.neotomae, от гончих собак B.canis.Брецели имеют хорошо выраженные антигенные свойства. Они содержат поверхностный Vi-антиген и видоспецифические соматические А и М, количественное соотношение которых неодинаково у разных видов. В B.melitensis преобладает М-антиген, в В.abortus и B.suis — антиген А. Для идентификации бруцелл используют монорецепторными сыворотки.Основными носителями бруцелл являются козы, овцы (B.melitensis), крупный рогатый болезнь (B.abortus), свиньи (B.suis) и северные олени (B.rangiferis). От больных животных возбудитель выделяется с молоком, мочой, испражнениями и особенно с околоплодными водами во время окотов и отелей. Человек заражается от животных контактно-бытовым путем или через сырое молоко и молочные продукты. Заболевание носит профессиональный характер. Чаще болеют пастухи, доярки, ветеринарные работники, скотоводы.Лабораторную диагностику бруцеллеза проводят с помощью бактериологических и серологических исследований, биологической и аллергической пробы, а также метода ДНК / ДНК гибридизации.Материалом для исследования может быть кровь, костный мозг, фекалии, желчь, моча, ликвор, мокрота, пунктат лимфатических узлов, у животных — выкидыши, околоплодные воды, а также молоко и молочные продукты.В связи с частыми лабораторными заражениями бруцеллезом выделения чистых культур и заражения гвинейских свинок позволяют проводить только в специальных режимных отделах санэпидемстанции. Серологические исследования выполняют в обычных бактериологических лабораториях.
Бактериологическое исследование
Для выделения гемокультуры из локтевой вены берут 10-20 мл крови и поровну засевают в два флакона с печеночным, сывороточным декстрозных бульоном или МПБ с глюкозой, глицерином и антифаговою сывороткой для подавления бруцеллезного бактериофага. Один флакон инкубируют в обычных аэробных условиях, второй — в атмосфере 10% С02 (для роста В. abortus). Особенностью бруцелл очень медленный рост на средах при выделении от больных, поэтому посевы следует выдерживать в термостате до 4-5 недель, делая висел на элективные Агари каждые 4-5 дней. Наилучшей средой для выращивания бруцелл является сывороточный декстрозных агар (МПА, 5% сыворотки, 1% декстрозы). Для ускорения исследования посевы крови проводят в два прямоугольных флаконы по методу Кастанеды. Флаконы содержат, кроме бульона, еще и слой агара на одной или обеих стенках. Начиная с 4-го дня после посева, флаконы периодически покачивают для того, чтобы оросить бульоном поверхность агара. В случае положительного результата на агаре вырастают колонии бруцелл, которые отсеивают на элективные среды и проводят идентификацию. Если в течение месяца колонии не растут, делают высев из бульона на плотную среду.Получение гемокультуры является одним из основных методов бактериологической диагностики бруцеллеза у людей. Если болезнь вызывает В. melitensis, гемокультура высевается в 65-90% случаев, при заражении В. abortus — в 5-15%. Иногда гемокультура вырастает уже с первых дней лихорадки.Хорошие результаты в острой и хронической стадиях болезни дают посевы пунктатов костного мозга. Миелокультуру удается выделить в 2 раза чаще, чем гемокультуру. Несколько капель аспирата костного мозга засевают в две пробирки с тем же средой. Мочу для выделения уринокультуры и желчь для выделения биликультуры, а также молоко сначала центрифугируют. Из осадка или сливок делают высев по 0,1 -0,2 мл на чашки с агаром «Д», (или печеночным), к которому добавляют генциановый фиолетовый в разведении 1:200 тыс. для задержания роста сопутствующей микрофлоры.Очень эффективны посевы материала в желток куриных жировых (неоплодотворенных) яиц или в желточный мешок куриного эмбриона. Кровь больного или аспират костного мозга разводят бульоном 1:3 и по 0,1-0,2 мл инокуляцию в несколько яиц. Зараженные яйца инкубируют при 37 ° С 5 дней и по 0,5 мл их содержания высевают на жидкие и плотные среды. Рост бруцелл наблюдается уже через 2-3 дня.Если посевной материал (фекалии, моча, мокрота, гной и т.д.) контаминови посторонними микробами, его сначала центрифугируют, осадок разводят генциановый фиолетовым в 3-5 раз и по 0,2 мл вносят в яйца или эмбрионы с последующим посевом на элективные агар.Колонии бруцелл на агаре мелкие (0,1-0,5 мм), круглые, выпуклые, гомогенные с перламутровым оттенком. Бруцеллы могут образовывать как S-, так и R-формы колоний (особенно В. ovis, В. suis и В. canis). С помутневшего бульона и типичных колоний изготовляют мазки, окрашивают по Граму и отсеивают на скошенный агар для выделения чистой культуры.Идентификация культур проводится по морфологическим, культуральным, биохимическим свойствам и на основе реакции агглютинации видовыми и монорецепторными сыворотками. Теперь есть надежные тесты для дифференциации основных видов и биовары бруцелл.
Биологическая проба
Наиболее чувствительными лабораторными животными является гвинейские свинки и белые мыши. До заражения животных прибегают тогда, когда исследуемый материал сильно загрязнен посторонней микрофлорой и высеять из него чистую культуру трудно. Кровь больных, ликвор, экссудат из суставов вводят в брюшную полость (гвинейским свинкам 2-3 мл, мышам — 0,5-1,0 мл). Осадок мочи, околоплодных вод, молока вводят подкожно в паховой области. Через 20-30 дней после заражения проводят вскрытие животных, сеют кровь из сердца и эмульгированные паренхиматозные органы и лимфатические узлы на жидкие и плотные элективные среды. Перед посевом у свинок берут кровь из сердца для постановки реакции агглютинации с целью выявления антител. Положительной биопробу считают тогда, когда выделяют бруцеллы любого вида, или при положительной реакции агглютинации в разведении сыворотки 1:20 и более.Для выявления бруцеллезной антигенов в сыворотке крови, которые могут быть свободными или в виде циркулирующих иммунных комплексов, применяют РНГА при использовании эритроцитарных диагностикумов с моноклональными антителами к родоспецифичних антигенов бруцелл. Используют также реакцию коаглютинации и преципитации, а также метод иммуноферментного анализа.
Серологические исследования
Серологические исследования при бруцеллезе включают реакцию агглютинации Райта, ускоренные пластинчатые реакции на стекле: Хеддлсона, рас-бенгал, латексагглютинации, непрямую реакцию гемолиза. С объемных серологических реакций используют РСК, реакции Кумбса (для выявления неполных антител), РНГА, ИФА, РИФ, опсонофагоцитарну пробу. Из них чаще всего используют реакции Райта, Хеддлсона и РНГА.Реакция Райта — один из основных официальных методов диагностики бруцеллеза во всех странах. Она проста по технике постановки, весьма чувствительна и специфична, оказывается в начале заболевания, достигает диагностического титра на второй неделе и сохраняется положительной в течение 1-4-х лет. Следовательно, ее можно использовать как для диагностики острого периода болезни, так и для установления ретроспективного диагноза. Реакцию ставят по классической схеме в пробирках методом одинаковых объемов.Примечание: КС — контроль сыворотки, КД — контроль диагностикума.Сыворотку больного и диагностикум разводят изотоническим раствором хлорида натрия, к которому заранее добавляют 0,5% фенола (карболизований изотонический раствор). При постановке реакции Райта и Хеддлсона используют единый бруцеллезной диагностикум, который является 10 млрд взвесью убитых нагреванием и фенолом бруцелл, окрашенных анилиновых красителей в синий цвет. Перед постановкой реакции его разводят в 10 раз.Пробирки встряхивают и ставят в термостат на 18-20 ч, затем еще выдерживают 2 часа при комнатной температуре и учитывают результаты обычным способом или по 50% агглютинации (2 +). Серийные разведения 50% агглютинации 1:50, 1:100-1:800 свидетельствует о том, что 1 мл сыворотки больного содержит соответственно 50, 100 … 800 МЕ антител. Интенсивность реакции оценивают по следующей схеме: 50 МЕ-реакция сомнительная, 100-200 МЕ — положительная, 400-800 МЕ — резко положительная. Реакция Райта может быть положительной у переболевших ранее и у привитых лиц, поэтому с развитием болезни ее ставят повторно и учитывают нарастание титра антител.Часто используют микрометод реакции агглютинации на стекле — пластинчатую реакцию Хеддлсона, особенно при массовых обследованиях на бруцеллез. Для этого хорошо обезжиренную стеклянную пластину 8×12 см разделяют восковым карандашом на 6 одинаковых квадратов. Неразведенную сыворотку больного и бруцеллезной диагностикум наносят с помощью пипеток согласно схеме. Капли сыворотки и антигена смешивают осторожным покачиванием пластины или стеклянной палочкой, слегка подогревают над пламенем газовой горелки. Максимальный срок наблюдения 8 мин. При положительной реакции в смешанных каплях появляются хлопья, а жидкость становится более-менее прозрачной. Агглютинация во всех 4-х квадратах оценивается как резко положительная, в 3-й и 4-й дозах — положительная, во 2-й дозе — слабо положительная — и только в дозе 0,8 мл — сомнительна. Отсутствие агглютинации со всеми дозами сывороток оценивают как отрицательную реакцию.Для ускоренной диагностики бруцеллеза используют также реакцию агглютинации бенгальского розового с кислым антигеном. Антиген готовят из густой взвеси бруцелл, убитых нагреванием, с использованием буферного раствора (рН 3,6 — 3,8) и красителя бенгальского розового. На стеклянную пластинку наносят 0,03 мл неразведенной сыворотки и 0,03 мл антигена, смешивают их круговым движением стеклянной палочки. Результат реакции учитывают через 4 мин. Появление крупно-или мелкозернистой аглютинату свидетельствует о положительной реакции.Реакция связывания комплемента относится по обычной схеме. Она становится положительной с 20-25-го дня заболевания и долго хранится.Постановку опсоно-фагоцитарной пробы последнее время проводят редко. Зато стали широко использовать РНГА.
Реакция непрямой гемагглютинации
Реакция непрямой гемагглютинации при бруцеллезе является специфической и высокочувствительной. Для ее проведения используют эритроцитарный бруцеллезной полисахаридный диагностикум. Чаще РНГА ставят в полистирилових прозрачных планшетах с лунками (можно и в пробирках).Исследуемую сыворотку (а также заведомо положительную и отрицательную для контроля) инактивируют при температуре 56 ° С в течение 30 мин. Для ее серийного разведения используют нормальную сыворотку кролика, предварительно разведенную 1:100. Реакцию ставят по такой схеме.Реакция наступает через 1-2 ч при комнатной температуре. Учет ее проводят через 2 часа. Если гемагглютинация наступает с разведением сыворотки 1:50 — реакция сомнительная; 1:100 и выше — положительная.Реакция Кумбса при бруцеллезе также специфическая и высокочувствительная. Она является ценным диагностическим тестом особенно при хронических формах заболевания у людей и животных.
Аллергическая проба Бюрне
Аллергическая проба Бюрне используется, для диагностики бруцеллеза, особенно при отрицательных бактериологических и серологических исследованиях. Пробу ставят, начиная с 15-20-го дня заболевания. В средней трети предплечья вводят внутрикожно 0,1 мл бруцелину (меллитин, абортину). Он является протеиновым экстрактом из культуры бруцелл. Положительной реакцией считают инфильтрат, покраснение размером 2×3 см и более, которые возникают через 24-48 часов. Аллергическая проба бывает положительной после перенесенного заболевания, а также у привитых. Это снижает диагностическую ценность пробы Бюрне.
Профилактика и лечение
В Украине проводится вакцино-профилактика бруцеллеза живой вакциной. Для предупреждения рецидивов применяют специфический иммуноглобулин, а также инактивированную вакцину. Для выявления ГЗТ используют бруцеллин-фильтрат убитой нагреванием бульонной культуры бруцелл. В качестве этиотропных химиотерапевтических препаратов используют антибиотики широкого спектра действия.
Постановка реакции агглютинации (реакция Райта) на бруцеллез
Постановка реакции агглютинации (реакция Райта) на бруцеллез
1. Для постановки реакции агглютинации на бруцеллез применяются свежие сыворотки, не имеющие гнилостного запаха, значительной коагуляции белка и гемолиза. Допускается исследование сывороток, консервированных фенолом до 0,5%, со сроком их давности не свыше 15 дней.
2. Реакция ставится на физиологическом растворе (0,85%) поваренной соли в 4 разведениях: для свиней, коз, овец и собак 1 : 25; 1 : 50; 1 : 100; 1 : 200, для крупного рогатого скота лошадей и верблюдов 1 : 50; 1 : 100; 1 : 200; 1 : 400 в количестве 1 мл каждого разведения в пробирках с ровным выпуклым дном.
При массовых исследованиях допускается постановка реакции в двух первых разведениях: для свиней, овец, коз и собак 1 : 25 и 1 : 50, для крупного рогатого скота, лошадей и верблюдов 1 : 50 и 1 : 100.
Для предохранения от прорастания посторонней микрофлорой рекомендуется постановка реакции на фенолизированном 0,5% физрастворе.
3. Контроль реакции ставится:
а) с отрицательной — негативной сывороткой в тех же разведениях, как и испытуемые сыворотки;
б) с положительной — позитивной сывороткой до предельного титра;
в) антиген с 1 мл физраствора.
4. Во все пробирки, в том числе и контроль, при постановке прибавляется 0,05 мл 10-миллиардного антигена, приготовленного согласно особой инструкции. Затем все пробирки тщательно встряхиваются до получения равномерной взвеси.
Допускается разлив сывороток в соответствующих дозах и микропипеткой. В этом случае антиген приливается по 1 мл, предварительно разведенный до 500 миллионов микробных тел в 1 мл. Сыворотки разливаются в дозах 0,04, 0,02, 0,01 и 0,005, что соответствует разведениям 1 : 25; 1 : 50; 1 : 100; 1 : 200.
5. При разливе сывороток обязательна тщательная промывка пипеток после каждой сыворотки не менее 6 раз в двух-трех посудах.
6. После тщательного встряхивания пробирки ставятся на 4—10 часов в термостат при температуре 37—38°С, затем пробирки выдерживаются при комнатной температуре 24—18 часов.
Учет реакции производится макроскопически.
7. Диагностически положительной испытуемая проба сыворотки считается при наличии макроскопической агглютинации в разведении 1:50 для свиней, овец, коз и собак и 1 : 100 для крупного рогатого скота, лошадей и верблюдов с оценкой их не менее чем на два креста.
8. Диагностически сомнительной испытуемая проба сыворотки считается при наличии макроскопической агглютинации только в разведении 1 : 25 для свиней, овец, коз, собак и 1 : 50 для крупного рогатого скота, лошадей, верблюдов с оценкой не менее чем на два креста.
9. Все сыворотки, давшие агглютинацию в каких-либо разведениях, исследуются повторно из той же пробы в 4 разведениях: для свиней, овец, коз и собак: 1 : 25; 1 : 50; 1 : 100; 1 : 200; для крупного рогатого скота, лошадей, верблюдов: 1 : 50; 1 : 100; 1 : 200; 1 : 400. При получении сомнительной реакции кровь от животного берется повторно через 3—4 недели.
10. При получении положительных или сомнительных реакций в ответе хозяйству указывается разведение, в котором получена реакция.
11. Сыворотки крупного рогатого скота, поступающие из хозяйств, в которых имелись или имеются аборты на почве бруцеллеза или выделяется значительное количество положительно реагирующих по реакции агглютинации (свежая инфекция), исследуются в 4 разведениях: 1 : 25; 1 : 50; 1 : 100; 1 : 200. При наличии макроскопической агглютинации в разведении 1 : 25, 1 : 50 не менее чем на два креста проба считается диагностически сомнительной. Если через 3—4 недели при повторном исследовании сывороток сомнительно реагирующих животных титр агглютинации не будет превышать 1 : 25, то проба признается диагностически отрицательной.
12. Если при исследовании сывороток свиней и лошадей будут получены только сомнительные реакции (у свиней 1 : 25, у лошадей 1 : 50) и при повторной проверке этих животных титр агглютинации не повысится, то при условии отсутствия в хозяйстве клинических признаков бруцеллеза среди этих видов животных и реагировавших в более высоких разведениях пробы признаются диагностически отрицательными.
13. Оценка реакции агглютинации в крестах:
++++ полное просветление жидкости при наличии явно выраженного зонтика (при встряхивании зонтик разбивается на хлопья, комочки и крупинки);
+++ те же явления, что отмечены для 4 крестов, но жидкость слегка опалесцирует (недостаточно полное просветление);
++ просветление жидкости выражено слабо, имеется наличие зонтика, который при встряхивании разбивается на хлопья, комочки и крупинки;
+ отсутствие или весьма незначительное просветление при наличии слабо выраженного зонтика или его следов, при встряхивании в жидкости заметны комочки и крупинки;
— отрицательная реакция агглютинации.
Отсутствие просветления и зонтика. Микробы могут оседать на дно в виде точки, при встряхивании разбиваются в равномерную муть.
РЕАКЦИИ АГГЛЮТИНАЦИИ
В этих реакциях принимают участие антигены в виде частиц (микробные клетки, эритроциты и другие корпускулярные антигены), которые склеиваются антителами и выпадают в осадок.
Для постановки реакции агглютинации (РА) необходимы три компонента: 1) антиген (агглютиноген);
2) антитело (агглютинин)
3) электролит (изотонический раствор натрия хлорида).
Ориентировочная реакция агглютинации (РА)
Ориентировочная, или пластинчатая, РА ставится на предметном стекле при комнатной температуре. Для этого пастеровской пипеткой на стекло наносят раздельно каплю сыворотки в разведении 1:10 — 1:20 и контрольную каплю изотонического раствора натрия хлорида. В ту и другую бактериологической петлей вносят колонии или суточную культуру бактерий (каплю диагностикума) и тщательно перемешивают их. Реакции учитывают через несколько минут визуально, иногда с помощью лупы (х5). При положительной РА в капле с сывороткой отмечают появление крупных и мелких хлопьев, при отрицательной — сыворотка остается равномерно мутной.
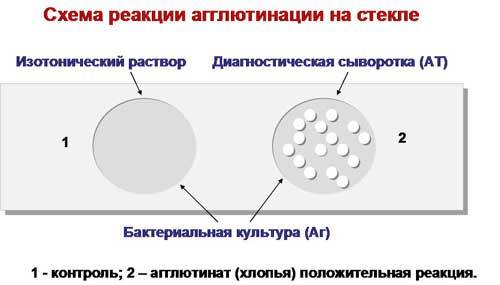
Рис. 2. Ориентировочная реакция агглютинации.
Развернутая реакция агглютинации с целью выявления титра специфических антител у больного.
Развернутая РА для серодиагностики ставится в сыворотке больных. Ее разводят и изотоническом растворе натрия хлорида от 1:50 — 1:100 до 1:800 или 1: 1600. Так как в более низких титрах сыворотки могут находиться нормальные агглютинины, имеющиеся у здоровых людей или больных с другим диагнозом (диагностический титр). В качестве антигена в этой реакции используют диагностикумы — заведомо известные взвеси, как правило, убитых бактерий.
В агглютинационные пробирки предварительно разливают по 1 мл изотонического раствора натрия хлорида. В первую из них доливают 1 мл сыворотки, разведенной 1:100, и, смешав ее, 1 мл переносят во вторую, из второй — в третью и т.д. В полученные двухкратные разведения сывороток (от 1:100 до 1:1600 и более) вносят по 1-2 капли взвеси бактерий, содержащей 3 млрд микробных тел в 1 мл. Пробирки встряхивают и помещают в термостат при 37°С на 2 часа, затем сутки выдерживают при комнатной температуре.
Учет реакции развернутой агглютинации производят, оценивая последовательно каждую пробирку, начиная с контрольных, при осторожном встряхивании. В контрольных пробирках агглютинации не должно быть. Интенсивность реакции агглютинации отмечают следующими знаками: ++++ — полная агглютинация (хлопья агглютината в абсолютной прозрачной жидкости); +++ — неполная агглютинация (хлопья в слабоопалесцирующей жидкости); ++ — частичная агглютинация (хлопья четко различимы, жидкость слегка мутная); + — слабая, сомнительная агглютинация — жидкость очень мутная, хлопья в ней плохо различимы; — — отсутствие агглютинации (жидкость равномерно мутная).
За титр сыворотки принимают последнее ее разведение, в котором интенсивность агглютинации оценивается не менее чем два плюса (++)
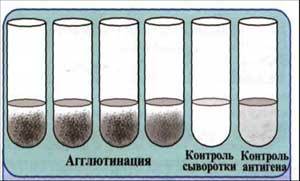
Рис. 7. Развернутая реакция агглютинации.
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА)
Реакция ставится:
1) для обнаружения полисахаридов, белков, экстрактов бактерий и других высокодисперстных веществ, риккетсий и вирусов, комплексы которых с агглютининами в обычных РА увидеть не удается,
2) для выявления антител в сыворотках больных к этим высокодисперстным веществам и мельчайшим микроорганизмам.
Под непрямой, или пассивной, агглютинацией понимают реакцию, в которой антитела взаимодействуют с антигенами, предварительно адсорбированными на инертных частицах (латекс, целлюлоза, полистерол, оксид бария и др. или эритроциты барана, I(0)-группы крови человека)
В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Сенсибилизированные антигеном эритроциты используют в РПГА как эритроцитарный диагностикум для обнаружения антител (серодиагностика). Если нагрузить эритроциты антителами (эритроцитарный антительный диагностикум), то можно применять для выявления антигенов.
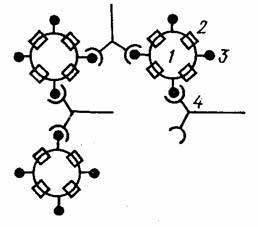
Рис. 3. Схема РПГА: эритроциты (1), нагруженные антигеном (3), связываются специфическими антителами (4).
Постановка. В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят — 0,5 мл заведомо положительной сыворотки и в последнюю 0,5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0,1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном — оседают в виде пуговки или колечка.
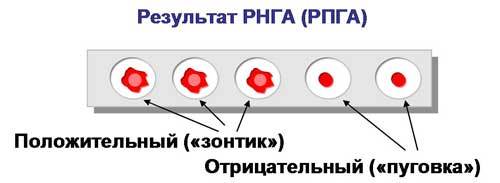
Рис.4. Учет РНГА (РПГА).
Учет результатов РНГА, поставленной с целью обнаружения ботулотоксина.
Возбудитель ботулизма — Clostridium botulinum вырабатывает токсины семи сероваров (А, B, C, D, E, F, G), однако чаще других встречаются серовары А, В, Е. Все токсины отличаются по антигенным свойствам и могут быть дифференцированы в реакциях типоспецифическими сыворотками. Для этой цели можно поставить реакцию пассивной (непрямой) гемагглютинации с сывороткой больного, в которой предполагается наличие токсина, и эритроцитами, нагруженными антителами антитоксических противоботулинических сывороток типов А, В, Е. Контролем служит нормальная сыворотка.

Рис. 3. Постановка и результат РНГА.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном — оседают в виде пуговки или колечка.
Вывод: В сыворотке больного обнаружен ботулотоксин тип Е.
Реакция торможения гемагглютинации (РТГА).
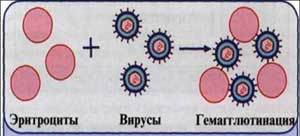
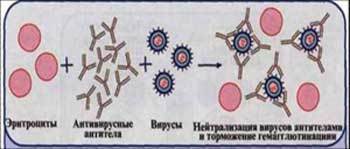
Рис. 8. Реакция торможения гемагглютинации (РТГА) (схема).
Принцип реакции основан на способности АТ связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг.
Типирование вируса проводят в реакции РТГА с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса типа А с антигенами H0N1, H1N1, H2N2, H3N2 и другие могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток
АГГЛЮТИНАЦИЯ
АГГЛЮТИНАЦИЯ (позднелатинское agglutinatiq — склеивание) — склеивание и выпадение в осадок корпускуллярных частиц — бактерий, эритроцитов, лейкоцитов, тромбоцитов, клеток тканей, корпускулярных химически активных частиц с адсорбированными на них антигенами или антителами, взвешенных в среде электролитов.
Антитела, вызывающие реакцию АГГЛЮТИНАЦИИ, называют агглютининами, а антигены, участвующие в реакции,— агглютиногенами. Агглютинины называют обычно соответственно клеткам, которые взяты в реакцию. Так, например, агглютинины против эритроцитов — гемагглютининами, против лейкоцитов — лейкоагглютининами и т. д.
Различают агглютинины полные и неполные. Реакция Агглютинации позволяет обнаруживать антитела в сыворотке крови, экстрактах тканей, секретах организма при инфекционных заболеваниях, при ауто-, изо- и гетероиммунизации (см. Группы крови, Иммуногематология), аллергических состояниях.
Реакция АГГЛЮТИНАЦИИ может быть специфической, неспецифической и спонтанной. Специфическая реакция АГГЛЮТИНАЦИИ возникает под влиянием сывороток животных или человека (см. Антитела), иммунизированных различными антигенами (см. Антигены, Антиген — антитело реакция), или нормальных сывороток человека. Неспецифическая реакция АГГЛЮТИНАЦИИ возникает, когда агрегация и выпадение в осадок корпускулярных частиц происходит под влиянием изменения факторов внешней среды (pH среды, концентрации солей, повышения или понижения температуры и др.).
К неспецифической реакции агглютинации может быть отнесена реакция АГГЛЮТИНАЦИИ эритроцитов человека и животных (см. Гемагглютинация) под действием водных экстрактов из семян и плодов некоторых видов растений.
Среди растений, главным образом бобовых, были обнаружены гемагглютинины, обладающие и специфической способностью агглютинировать эритроциты человека только определенных серологических типов. Антителам, содержащимся в солевых экстрактах плодов и семян многих видов растений (фитогемагглютинины), присущи свойства, наблюдающиеся у агглютининов специфических сывороток, полученных от иммунизированных животных. Эти фитогемагглютинины получили название лектинов (см.).
Спонтанная реакция АГГЛЮТИНАЦИИ наблюдается в случаях, когда бактерии при размножении не делятся на отдельные клетки, а остаются связанными между собой в цепи или гроздья. Такие суспензии не гомогенны. Часть культуры всегда находится в осадке. Под действием бактерий и вирусов эритроциты могут давать спонтанную АГГЛЮТИНАЦИЮ.
В инфекционной иммунологии реакция специфической Агглютинации применяется для диагностики различных инфекционных заболеваний, для идентификации микроорганизмов, выделенных от больных и бактерионосителей, для изучения иммунного ответа организма при инфекции и профилактической иммунизации.
Впервые реакция АГГЛЮТИНАЦИИ бактерий была описана Шарреном и Роже (A. Charrin, G. Н. Roger, 1890) и И. И. Мечниковым (1891). Практическое применение реакции Агглютинации было предложено Грубером, Дархемом и Видалем (М. Gruber, Н. Е. Durham, F. Widal, 1896) для диагностики брюшного тифа (см. Видаля реакция).
Реакция АГГЛЮТИНАЦИИ бактерий выполняется в пробирках в объеме 1 мл (макроскопическая развернутая реакция АГГЛЮТИНАЦИИ). В штатив устанавливается ряд пробирок с номерами. Во все пробирки, кроме первой, наливают изотонический раствор хлорида натрия, затем в первую и вторую пробирки вносят 1 мл иммунной сыворотки в разведении 1 : 100. После смешивания из второй пробирки забирают 1 мл сыворотки в разведении 1 : 200 и переносят я третью пробирку и т. д. Из предпоследней пробирки 1 мл разведенной сыворотки выливают. В последнюю пробирку сыворотку не вносят. В каждую пробирку добавляют по две капля густой взвеси изучаемых бактерия (2 млрд. микробных тел в 1 мл по оптическому стандарту) и энергично встряхивают. Последняя пробирка является контролем гомогенности культуры изучаемых бактерий. Количество антигена в каждой пробирке одинаково. Первая фаза реакции протекает при t° 37° в термостате в течение 2 час., затем 18 час. при комнатной температуре. Учитывают показания реакции АГГЛЮТИНАЦИИ, как правило, невооруженным глазом. В последней, контрольной, пробирке должна быть равномерная взвесь бактерий.
Реакция АГГЛЮТИНАЦИИ оценивается следующим образом:
++++ полная агглютинация, жидкость прозрачна, культура в осадке;
+++ неполная агглютинация, жидкость не полностью прозрачна, имеется осадок;
++ слабая агглютинация, жидкость не прозрачна, имеется осадок;
+ следы агглютинации, жидкость не прозрачна, небольшой осадок;
— отрицательная реакция, во всех пробирках взвесь равномерно мутная, осадка нет.
За титр сыворотки принимается ее разведение, давшее реакцию АГГЛЮТИНАЦИИ на + + при полном отсутствии АГГЛЮТИНАЦИИ в контрольной пробирке.
Осадок, выпадающий при положительной реакции АГГЛЮТИНАЦИИ, может иметь вид крупных рыхлых хлопьев пли мелких компактных зерен. Крупнохлопчатый осадок образуют бактерии, имеющие два антигена: жгутиковый — Н-антиген и соматический — О-антиген (см. Бактерии, антигены бактерий). Крупные хлопья при полной АГГЛЮТИНАЦИИ выпадают в осадок в течение 2—4 час. Мелкозернистый осадок образуют бактерии, не имеющие жгутиков. Эти бактерии имеют только один соматический антиген. В процессе АГГЛЮТИНАЦИИ тела бактерий склеиваются и медленно (в течение 18 часов) выпадают в осадок.
С целью более точного определения степени проявления реакции АГГЛЮТИНАЦИИ применяют различные приборы: агглютиноскоп, фотоэлектрический денситометр, фотоэлектрический колориметр, спектрофотометр.
В практической работе применяется капельный метод постановки реакции АГГЛЮТИНАЦИИ в пробирках и на предметном стекле. Предложено несколько модификаций капельного метода постановки реакции АГГЛЮТИНАЦИИ, начиная от смешивания неразведенной специфической сыворотки с равным количеством исследуемой бактериальной культуры до разведения сыворотки 1 : 400.
Результаты реакции АГГЛЮТИНАЦИИ на предметном стекле учитывают через 5 мин. при постоянном покачивании предметного стекла или через 30 мин., если предметное стекло находится во влажной камере. Реакция АГГЛЮТИНАЦИИ на предметном стекле чаще употребляется как ориентировочная (см. Нобля реакция). Можно снять половину колонии изучаемой культуры бактерий в твердой питательной среды и в реакции АГГЛЮТИНАЦИИ на предметном стекле определить их вид. Реакция АГГЛЮТИНАЦИИ на предметном стекле полностью удовлетворяет цели исследования, если применяются адсорбированные монорецепторные сыворотки.
Часто специфические сыворотки, полученные от иммунизированных животных или больных людей, дают положительную реакцию АГГЛЮТИНАЦИИ не с одним предполагаемым возбудителем заболевания, а и с другими видами микроорганизмов. Так, например, сыворотка больных брюшным тифом может агглютинировать в высоких титрах не только брюшнотифозную палочку, но и бактерии, вызывающие паратиф А и В (групповая АГГЛЮТИНАЦИЯ). Это указывает на общность антигенов этих бактерий. Принято считать, что заболевание вызвал микроорганизм, который агглютинируется сывороткой больного в более высоком титре, чем другие виды бактерий. По различие титров в реакции АГГЛЮТИНАЦИИ нередко бывает незначительным, и в этих случаях применяют метод адсорбции агглютининов (см. Кастеллани метод). Он основан на том, что специфическую сыворотку насыщают несколькими культурами, которые агглютинируются этой сывороткой. В пробирке, где добавлена специфическая культура, адсорбируются все агглютинины, а там, где добавлена неспецифическая культура, адсорбируются только групповые агглютинины (специфические остаются свободными).
В целях повышения чувствительности реакции АГГЛЮТИНАЦИИ часто применяется пассивная реакция АГГЛЮТИНАЦИИ. Сущность этой реакции состоит в том, что специфические антигены и антитела взаимодействуют на поверхности инертных частиц, которые при положительной реакции выпадают в осадок. В качестве корпускулярных частиц для адсорбции антигенов и антител были предложены различные адсорбенты, но для практического применения приемлемы только те, которые обладают высокой адсорбционной емкостью, однородностью частиц и наименьшей склонностью к спонтанной АГГЛЮТИНАЦИИ. К таким адсорбентам относятся эритроциты человека и животных, частицы латекса, коллодия, бентанита и др.
Реакция пассивной АГГЛЮТИНАЦИИ с диагностической целью была предложена А. Т. Кравченко (1943) и М. И. Соколовым (1945). Эритроциты человека нагружались гаптенами, приготовленными из бактериальных клеток возбудителей инфекционных заболеваний. Эти эритроциты приобретали способность агглютинироваться под действием специфической сыворотки.
Предложено несколько модификаций пассивной реакции АГГЛЮТИНАЦИИ нагруженных нативных эритроцитов и реакция торможения пассивной АГГЛЮТИНАЦИИ нагруженных эритроцитов. Эритроциты человека и животных, предварительно обработанные таниновой кислотой, приобретают способность в большей степени адсорбировать на своей поверхности белковые антигены (см. Бойдена реакция). Обработка эритроцитов таниновой кислотой сближает их свойства с индифферентными частицами.
Для практических целей были предложены эритроцитарные диагностикумы — эритроциты, нагруженные антигенами различных видов бактерий или антителами. Эритроцитарные диагностикумы приготовляются для диагностики брюшного тифа, дизентерии, холеры и других желудочно-кишечных заболеваний, а также чумы, коклюша, сыпного тифа. Кроме того, эритроцитарные диагностикумы применяются при исследовании природы аллергических реакций.
Практическое применение нашел так называемый латекс-тест. Частицы латекса являются промежуточным продуктом синтеза каучука. Взвесь частиц латекса размером 0,79—0,81 мкм выпускается специально для серологических исследовании. Исходная взвесь латекса фильтруется для удаления частиц большего размера. Взвесь частиц латекса разводится в отношении 1 : 10 боратным или глициновым буфером (pH=8,2). Приготовленную взвесь «нагружают» антигеном или антителами в соотношении 1:10 и выдерживают при 37° 2 часа.
Частицы латекса, нагруженные антигеном или антителами, можно использовать в реакции определения неизвестного антигена по известной сыворотке или по известному антигену определяют неизвестную сыворотку. Две капли разведенной буфером неизвестной сыворотки, предварительно прогретой при 56° в течение 30 мин., смешивают на предметном стекле с одной каплей нагруженных антигеном частиц латекса. Реакция наступает, как правило, быстро (2 — 3 мин.) и только в некоторых случаях требуется выдержать 30 мин. при t° 37°. Наступившая реакция АГГЛЮТИНАЦИИ частиц латекса хорошо видна невооруженным глазом на темпом фоне или под малым увеличением микроскопа.
Реакция АГГЛЮТИНАЦИИ широко используется для обнаружения антиэритроцитарных антител, а также антигенов в эритроцитах (см. Группы крови).
Важное значение, особенно в последнее время, приобрела реакция АГГЛЮТИНАЦИИ лейкоцитов (лейкоагглютинация). При помощи реакции лейкоагглютинации производится типирование лейкоцитарных антигенов, имеющих большое значение в проблеме трансплантации (см.).
Для постановки реакции лейкоагглютинации используют сыворотки, полученные от многорожавших женщин, сыворотки больных после многократных переливаний крови, содержащие антилейкоцитарные антитела. Реакция Агглютинации лейкоцитов производится с лейкоцитами, полученными из крови или лимфатических узлов (лимфоциты), ex tempore, так как лейкоциты, выделенные из крови, сохраняют жизнеспособность только 6 час.
При выделении лейкоцитов из крови необходимо принять все меры предосторожности, избегая повреждения клеток. Методы получения лейкоцитов из крови для реакции АГГЛЮТИНАЦИИ основаны на разной скорости оседания лейкоцитов и эритроцитов из дефибрированной крови. 10 мл изотонического раствора хлорида натрия, содержащего 2,5 г желатины, 3 г лимоннокислого натрия и 3 г сахарозы, при смешивании с кровью в соотношении 10 : 3 осаждают эритроциты полностью в течение 30 мин. В надосадочной жидкости остаются лейкоциты и тромбоциты. Осторожное центрифугирование надосадочной жидкости при 800 об/мин в течение 4 мин. позволяет получить лейкоциты в осадке, а тромбоциты в надосадочной жидкости. Осадок, состоящий из лейкоцитов, отмывают раствором еще дважды.
Получение лейкоцитов должно производиться при низкой температуре и в условиях стерильности, так как бактериальное загрязнение взвеси лейкоцитов влечет за собой спонтанную АГГЛЮТИНАЦИЮ.
Для лейкоагглютинации рекомендуется использовать взвесь лейкоцитов, содержащую от 3000 до 5000 лейкоцитов в 1 мкл (подсчет в камере Горяева). Сыворотку перед постановкой реакции лейкоагглютинации прогревают при t° 56° в течение 30 мин.
Реакция проводится в пробирках, на стекле с лунками или на пластинах органического стекла с лунками. Реагирующие жидкости берутся в соотношении 0,1 мл разведенной сыворотки на 0,05 мл взвеси лейкоцитов.
Объем реагирующей смеси можно варьировать. Смесь выдерживают при t° 37° в течение 1 часа. Затем в каждую пробирку добавляют по одной капле 3% раствора уксусной к-ты для удаления оставшихся при промывке эритроцитов. Реакцию лейкоагглютинации учитывают под малым увеличением микроскопа. Оценку показания реакции начинают с контрольной пробирки. Положительную реакцию оценивают, как обычную реакцию Агглютинации любых взвешенных частиц, по четырехбалльной системе.
Для изучения антигенного состава тромбоцитов (см.), а также обнаружения антитромбоцитарных антител в сыворотке больных после много кратных переливаний крови применяют реакцию Агглютинации тромбоцитов. Сложность постановки реакции АГГЛЮТИНАЦИИ тромбоцитов заключается в получении взвеси тромбоцитов без признаков спонтанной АГГЛЮТИНАЦИИ. Для получения такой взвеси тромбоцитов важен выбор антикоагулянта (см.), а также особая обработка посуды, исключающая повреждение тромбоцитов, их прилипание к поверхности посуды и спонтанную АГГЛЮТИНАЦИЮ.
Для реакции рекомендуется брать взвесь тромбоцитов в концентрации 150 000—250 000 клеток в 1 мкл.
Готовую взвесь тромбоцитов (перед тем как смешать с сывороткой) отстаивают в течение 30 мин. Испытуемая и контрольные сыворотки предварительно прогреваются при t° 56° в течение 30 мин. Реагирующую смесь помещают в термостат на 1 час. при 37°. Оценку реакции проводят под микроскопом при благополучном контроле по четырехбалльной системе. Однако более четкие результаты по изучению антигенного состава тромбоцитов получают при использовании реакции связывания комплемента (см.).
Реакция АГГЛЮТИНАЦИИ имеет две фазы. Первая фаза — специфическая, сводится к соединению антигенов бактерий, эритроцитов и других клеток, а также антигенов, адсорбированных на поверхности индифферентных частиц, с агглютинирующими антителами. Вторая фаза — неспецифическая, которая проявляется Агглютинацией. эритроцитов, бактерий, лейкоцитов, индифферентных частиц с нагруженным на них комплексом антиген — антитело.
Реакция АГГЛЮТИНАЦИИ, в отличие от реакции преципитации, может быть положительной при очень больших разведениях сыворотки. Точное количество антител, необходимое для того, чтобы вызвать реакцию Агглютинации, не известно. Показано, что общий объем продукта реакции Агглютинации всегда превышает исходный объем бактерий, но степень увеличения объема всегда различна и зависит от многих трудно учитываемых причин. Положительная реакция Агглютинации может быть вызвана количеством антител, во много раз меньшим, чем количество антител, способное адсорбироваться антигенами на поверхности клеток, бактерий или частиц. В некоторых случаях при постановке реакции Агглютинации могут наблюдаться зоны задержки. Отсутствие АГГЛЮТИНАЦИИ при больших разведениях сыворотки называется постзоной, а при малых разведениях — прозоной. Было установлено, что задержка реакции Агглютинации при максимальном количестве специфических антител вызывается ингибиторами, которые снижают силы сцепления бактерий. Неагглютинирующиеся бактерии после отмывания их снова становятся агглютинабельными при больших разведениях той же сыворотки. Надосадочная жидкость содержит ингибиторы, которые могут снижать сцепление бактерий, обработанных сыворотками. Ингибиторы, вызывающие прозону в реакции АГГЛЮТИНАЦИИ, имеют сходство с блокирующими антителами (см. Антитела).
Применение в научных исследованиях по иммунологии различных абсорбентов дало возможность моделировать процессы взаимодействия антигенов и антител на поверхности адсорбентов. Одной из удобных моделей для изучения закономерностей реакции АГГЛЮТИНАЦИИ являются эритроциты, нагруженные различными антигенами.
Было установлено, что взаимодействие нативных эритроцитов с полисахаридами кишечной палочки, возбудителем холеры, чумы и других бактерии подчиняется закономерностям химической реакции.
В настоящее время нет теории механизма реакции АГГЛЮТИНАЦИИ, удовлетворительно объясняющей все известные экспериментальные данные (см. Антиген — антитело реакция). В литературе известны теория адсорбции Борде, теория решетки Маррака. теория окклюзии Бойда и др. Наибольшее распространение получила теория решетки, согласно которой предполагается, что антитела имеют не менее двух активных центров, способных соединяться с детерминантными группами антигенов. Молекула специфического антитела, соединяясь с детерминантами двух или более антигенов, образует решетку — агрегат, который при наличии в среде электролитов выпадает в осадок. Реакция АГГЛЮТИНАЦИИ не происходит с неполными антителами. Считали, что неполные антитела имеют только один активный центр, следовательно, они могут только соединяться с антигеном, но не могут образовать агрегатов, которые выпадают в осадок. Высказано предположение, что неполные антитела тоже двухвалентные, но их активные центры расположены так близко друг к другу, что не могут одновременно соединиться с двумя молекулами антигена. Кроме того, известно, что обработка неполных антител или эритроцитов трипсином влечет за собой нормальное проявление второй фазы реакции Агглютинации. Обнаружение неполных антител возможно с помощью реакции Агглютинации: эритроциты, сенсибилизированные неполными антителами, могут быть использованы как антиген, если на них подействовать специфической антиглобулиновой сывороткой (см. Кумбса реакция).
Агглютинация в судебно-медицинском отношении — см. Группы крови.
См. также Серологические исследования.
Библиография: Адамов А. К. Принципы быстрого обнаружения патогенных микробов и вирусов, Саратов, 1964, библиогр.; Бойд У. Основы иммунологии, пер. с англ., с. 274, М., 1969; Говалло В. И. Реакции, основанные на феномене агглютинации, в кн.: Лабораторные методы исследования в неинфскционной иммунологии, под ред. О. К. Вязова, с. 73, М., 1967; Гостев В. С. Реакция антиген — антитело. Многотомн. руководство по микробиол., клин, и эпидемиол. инфекц. болезней, под ред. Н. Н. Жукова-Вережникова т. 3, с. 117, М., 1964, библиогр.; Косяков П. Н. Иммунология изоантигенов и изоантител, М., 1965, библиогр.;Мейер М. Экспериментальная жхмунохимия, пер. с англ.,с. 106, М., 1968;
А. Т. Кравченко.
Райта реакция
Райта реакция (А. Е. Wright) — серологический метод лабораторной диагностики бруцеллезной инфекции.
Реакция Райта высоко специфична и становится положительной с самого начала болезни. Наиболее высокие титры реакции Райта (80% и выше) обычно наблюдаются через 1—2 мес. после начала заболевания и сохраняются на протяжении лихорадочного периода. В дальнейшем титры реакции начинают падать, и к концу первого года заболевания реакция Райта, как правило, становится отрицательной. Появление и накопление агглютининов в крови больных бруцеллезом зависят от степени антигенного раздражения. Поэтому наиболее высокие показатели титров агглютининов наблюдаются в фазе бактериемии, резко снижаясь по мере затухания инфекционного процесса.
Иногда реакция Райта сохраняется положительной до 2—3 и даже 5 лет после перенесенного заболевания. Однако в этих случаях следует иметь в виду возможность повторного заражения и рецидивов заболевания. В некоторых случаях классического бруцеллеза (см.), подтвержденного выделением гемокультуры и положительной аллергической пробой, реакция Райта может быть отрицательной; это возможно при заражении организма измененным в антигенном отношении штаммом бруцелл. Благодаря некоторой общности в антигенной структуре слабоположительные результаты реакции Райта могут быть у людей, инфицированных возбудителями туляремии, холеры, и при некоторых других инфекционных заболеваниях, а также у лиц, вакцинированных против этих инфекций. Слабоположительная реакция Райта (в разведениях 1:50 и 1:100) иногда наблюдается и у здоровых женщин в последние недели беременности. Повторная постановка реакции Райта (наблюдение за ее динамикой) позволяет дифференцировать специфическую реакцию Райта от неспецифической, так как повышение титров указывает на наличие бруцеллезной инфекции.
Существенную роль в реакции Райта играет подбор штаммов для приготовления диагностикума (диссоциированные штаммы для этой цели не пригодны), а также концентрация применяемой микробной взвеси. Кроме антигена, источником ошибок может быть и исследуемая сыворотка. Она должна быть свежей, негемолизированной, прозрачной (без эритроцитов и пр.) и без признаков прорастания посторонней микрофлорой.
При постановке реакции Райта иногда наблюдаются так называемые проагглютинационные зоны, т. е. отрицательный результат с малыми разведениями сыворотки и четко выраженный положительный результат при более высоких разведениях; возможно также выпадение агглютинации в средней части ряда разведений. Явление это чаще наблюдается при высоких титрах сывороток и делает необходимым применение длинного ряда разведений. Появление феномена зоны, по-видимому, связано с наличием в сыворотках крови неполных (блокирующих) антител. Сыворотку крови для исследования получают обычным способом.
Реакцию Райта ставят всегда с двумя контролями: а) контроль каждой из исследуемых сывороток для исключения ложной агглютинации за счет выпадения белков самой сыворотки и б) контроль антигена — одна пробирка при любом количестве исследуемых сывороток — для исключения спонтанной агглютинации антигена. Физиол. раствор, применяемый для разведения сыворотки и антигена, должен изготовляться на дистиллированной воде нейтральной реакции (рН=6,9—7,1) и во избежание прорастания содержать 0,5% карболовой кислоты. Реакцию Райта ставят не менее чем в пяти разведениях (1:50, 1:100, 1:200, 1:400 и 1:800) в объеме 1 мл каждое. В качестве антигена применяют диагностикум, подтитрованный по национальной стандартной противобруцеллезной агглютинирующей сыворотке. Перед употреблением диагностикум разводят в 10 раз карболизированным (0,5%) физиологическим раствором. В 1 мл разведенного диагностикума содержится около 6-109 микробных клеток.
Учет реакции производят через 24 часа путем сравнения степени просветления в опытных пробирках с соответствующим стандартом мутности, который готовят следующим образом. В 4 пробирки последовательно наливают 1, 2, 3 и 4 мл разведенного диагностикума, затем в том же порядке добавляют 3, 2 и 1 мл карболизированного физиологического раствора, в последнюю пробирку ничего не добавляют. После взбалтывания содержимого берут по 0,5 мл антигена каждой концентрации и 0,5 мл карболизированного физиологического раствора. Таким образом получают 4 пробирки стандарта мутности с различной степенью просветления (75% — 3—, 50% — 2 — и 25% — 1 — и отсутствие просветления), которые вместе с опытными пробирками помещают в термостат при t° 37° на 24 часа, после чего производят учет реакции. Для единой системы учета в настоящее время рекомендуют выражение титров сывороток в международных единицах антител (ME). Диагностическим титром исследуемой сыворотки считается 50% агглютинации (2+).
Перечисление титра сыворотки на международные единицы производят следующим образом. Стандартизированный диагностикум со стандартной противобруцеллезной агглютинирующей сывороткой, содержащей 1000 ME антител в 1 мл, дает 50% агглютинации в разведении этой сыворотки 1 : 500. Следовательно, титры исследуемой сыворотки 1 : 50, 1 : 100, 1 : 200 и т. д. с применением стандартизированного диагностикума указывают на то, что в 1 мл исследуемой сыворотки содержится 100, 200, 400 и т. д. международных единиц антител. Таким образом, перечисление титра исследуемой сыворотки на международные единицы производят путем его удвоения. При диагностической оценке результатов реакции агглютинации рекомендуется следующая схема: титр сыворотки 1 : 50 (100 ME) — результат сомнительный, 1 : 100 (200 ME)— слабо положительный, 1 : 200 (400 ME) — положительный, 1 : 200 и выше (800 ME)— резко положительный.
Реакция Райта
Реакция Райта – один из самых распространенных, можно сказать, официальный способ диагностики бруцеллеза в мире. Как можно догадаться, изобрел метод выявления болезни ученый по фамилии Райт.
Нередко можно встретить информацию о том, что в каком-то конкретном случае проводился такой анализ, как реакция Райта-Хеддельсона. Метод выявления бруцеллеза по Хеддельсону имеет свои отличия, но в целом решает схожие задачи: выявление упомянутого заболевания у людей. Особенностей данного анализа мы тоже коснемся.
Кровь на реакцию Райта сдать очень просто, сама процедура проведения исследования – тоже несложная. При помощи анализа можно выявить заболевание как на ранней стадии, так и на поздней. Также имеется возможность поставить ретроспективный диагноз, так как исследование Райта выявляет антитела к бруцеллезу на протяжении 1-4 лет, спустя то время, как антиген попал в организм.
Особенности проведения реакции
Для осуществления реакции агглютинации Райта приготавливают особую смесь:
1. Берут сыворотку пациента.
2. Добавляют к ней диагностикум, состоящий из взвеси большого количества бруцелл.
3. Все это разводят раствором хлорида натрия с добавлением небольшого количества фенола.
Пробирки с указанной смесью помещают на 18-20 часов в термостат, после чего – выдерживают около 2 часов при комнатной температуре, а уже потом оценивают результаты. Нужно отметить, что соотношение диагностикума и сыворотки в каждой пробирке свое. На основе анализа степени прохождения реакции в каждой из пробирок, подводятся результаты исследования.
Результаты реакции Райта
Реакция Райта при бруцеллезе, или отсутствии болезнетворных организмов в теле, может дать следующие результаты:
• 50 МЕ – сомнительная реакция. Можно предположить, что пациент бруцеллезом не болен, а реакция произошла по каким-либо другим причинам. Необходимо дополнительное обследование.
• 100-200 МЕ – положительная реакция.
• 400-800 МЕ – резко положительная реакция, когда сомнений в наличии заболевания нет.
Положительная реакция может быть выявлена у тех, кто ранее уже победил бруцеллез, а также у лиц, которые были привиты от данной болезни. Естественно, что количество антител в организме таких людей будет не очень большим. Поэтому через какое-то время необходимо будет провести дополнительные исследования, чтобы понять: имеет ли место динамика роста числа антител. Если иммунные клетки, призванные бороться с бруцеллезом, увеличиваются в числе, то можно говорить о прогрессировании болезни.
Реакция Хеддельсона
Часто сдают кровь на реакцию Райта-Хеддельсона. Отметим, что при осуществлении реакции Хеддельсона используется тот же самый диагностикум, но метод несколько отличается от вышеописанного.
Метод осуществления реакции Хеддельсона
Можно отметить, что реакция Хеддельсона на бруцеллез – это экспресс-тест, который, конечно, часто позволяет выявить заболевание у пациента, но, скорее, дает возможность определить круг тех лиц, которые должны будут пройти дополнительные исследования. Поэтому-то сдается комплекс: реакция Райта-Хеддельсона на бруцеллез.
Для проведения исследования необходимо иметь:
• чистое обезжиренное стекло;
• восковой карандаш;
• сыворотку пациента;
• диагностикум;
• горелку или иной источник огня.
Проводится реакция таким образом: стекло разделяют карандашом на несколько квадратов. На каждый из квадратов помещают небольшое количество сыворотки, добавляют к ней диагностикум и все аккуратно перемешивают. Далее стекло нагревают над огнем на протяжении нескольких минут. Если антитела к бруцеллезу имеются, то сыворотка светлеет, в ней образуются хлопья.
Зачем может понадобиться купить анализы?
Иногда ситуация складывается таким образом, что сдавать анализы не имеется желания или возможности. Тогда можно купить анализы при условии, что вы уверены в отличном состоянии своего здоровья.
Анализы в Москве продает большое количество компаний различного уровня. Рекомендуем обратиться по данному вопросу именно в «Документы РФ», поскольку наша фирма обладает следующими преимуществами:
• Мы продаем справки в Москве в широком ассортименте и самого высокого качества. Полностью повторяем оригинал, используем специальное оборудование, указываем все необходимые реквизиты;
• Купить справки в Москве у нас – это недорого.
• Купить анализы в Москве в компании «Документы РФ» – это быстро.
РАЙТА РЕАКЦИЯ
РАЙТА РЕАКЦИЯ (A. E. Wright, англ. патолог и бактериолог, 1861 — 1947) — серологический метод лабораторной диагностики бруцеллеза.
В 1897 г. А. Райт и Смит (F. Smith) обнаружили способность сыворотки крови больных мальтийской лихорадкой агглютинировать возбудителя — микрококк Брюса. В том же году А. Райт и Семпл (D. Semple) предложили для серодиагностики ундулирующей лихорадки реакцию, в к-рой в качестве антигена использовали убитую нагреванием культуру возбудителя. В дальнейшем эта реакция под названием реакции Райта вошла в широкую практику для диагностики бруцеллеза у людей и животных (см. Бруцеллез).
Р. р. высокоспецифична и становится положительной в начале болезни. Наиболее высокие титры P.p. обычно наблюдаются через 1 — 2 мес. после начала заболевания и сохраняются на протяжении лихорадочного периода. В дальнейшем титры антител снижаются, и к концу первого года заболевания Р. р., как правило, становится отрицательной. Появление и накопление агглютининов в крови больных бруцеллезом находится в прямой зависимости от степени антигенного раздражения. Поэтому не случайно, что наиболее высокие показатели титра агглютининов обычно наблюдаются в фазе бактериемии, а по мере затухания инф. процесса они резко снижаются. Иногда Р. р. сохраняется положительной в течение 2—5 и даже 10 лет после перенесенного заболевания. Однако в этих случаях следует иметь в виду возможность повторного заражения и рецидивов заболевания. В некоторых случаях классического бруцеллеза, подтвержденного выделением гемокультуры и положительной аллергической пробой, Р. р. может быть отрицательной, напр, при заражении организма измененным в антигенном отношении штаммом бруцелл. Благодаря нек-рой общности в антигенной структуре слабоположительные результаты Р. р. возможны у больных туляремией, холерой, нек-рыми другими инф. болезнями, а также у лиц, вакцинированных против этих инфекций. Слабоположительная Р. р. (в разведениях 1:50 и 1:100) иногда наблюдается и у здоровых женщин в последние недели беременности. Повторная постановка Р. р. (наблюдение за ее динамикой) позволяет дифференцировать специфическую Р. р. от неспецифической — повышение титра антител указывает на наличие бруцеллеза.
Постановка Р. р. требует выполнения определенных условий. Сыворотка крови для исследования должна быть свежей, негемолизированной, прозрачной и без признаков прорастания посторонней микрофлорой. Существенную роль играют подбор штаммов для приготовления диагностикума (диссоциированные штаммы для этой цели не пригодны) и концентрация применяемой микробной взвеси. Единый бруцеллезный диагностикум представляет собой убитую стандартную бактерийную взвесь, содержащую в 1 мл 10 млрд. микробных клеток; в реакции используется взвесь, содержащая в 1 мл 1 млрд. микробных клеток, для чего диагностикум предварительно разводят изотоническим р-ром хлорида натрия в 10 раз.
Р. р. ставится по обычной методике, требуется не менее пяти раз-ведений сыворотки крови (1:50, 1:100, 1:200, 1:400 и 1:800) в объеме 1 мл каждое. Изотонический р-р хлорида натрия, применяемый для разведения сыворотки крови и антигена, должен изготовляться на дистиллированной воде нейтральной реакции (pH в пределах 6,9—7,1) и содержать 0,5% карболовой к-ты для предупреждения прорастания посторонней микрофлорой. Ставят Р. р. с двумя контролями: а) контроль каждой из испытуемых сывороток крови для исключения ложной агглютинации за счет выпадения белков самой сыворотки; б) контроль антигена для исключения спонтанной агглютинации антигена (одна пробирка при любом количестве испытуемых сывороток крови).
Диагностическим титром считается разведение сыворотки крови, давшее агглютинацию не ниже чем на 50% (++) при макроскопическом учете. Для оценки результатов Р. р. рекомендуется следующая схема: агглютинация при титре 1:50 — результат сомнительный, при титре 1:100 — слабо положительный, при титре 1:200 — 1:400 — положительный, при титре 1:800 и выше — резко положительный. При отрицательной или сомнительной реакции (титр 1 : 50) повторное исследование сыворотки крови больного проводят через 7—10 дней.
При постановке Р. р. иногда наблюдаются так наз. проагглютинационные зоны, т. е. отрицательный результат при малых разведениях сыворотки крови и четко выраженный положительный результат при более высоких разведениях; возможно также выпадение агглютинации в средней части ряда разведений. Явление это чаще наблюдается при высоких титрах сывороток крови и делает необходимым применение ряда разведений. Появление феномена проагглютинационной зоны, по-видимому, связано с наличием в сыворотках крови неполных (блокирующих) антител.
В соответствии с решением Комитета экспертов по биологической стандартизации ВОЗ оценку степени просветления, и следовательно степени агглютинации (см.), рекомендуется проводить по стандартам мутности. Эталоны мутности готовятся каждый раз при постановке Р. р. и ставятся в тех же условиях, что и основная реакция. Для оценки конечного разведения сыворотки крови принимается 50% агглютинации. При постановке реакции с учетом ее по стандарту мутности (см. Бактериальный стандарт) следует пользоваться пробирками одинакового размера как для основной реакции, так и для эталонов мутности; контроль антигена при этом не ставится.
Для серол. диагностики бруцеллеза у людей и животных в разных странах (и даже в пределах одной страны) применяют различные методы постановки Р. р. и оценки полученных результатов, что затрудняет их сравнение. В целях унификации в 1954 г. Комитет экспертов по биологической стандартизации ВОЗ рекомендовал принять единую систему выражения титров сывороток в международных единицах (ME). В качестве международной стандартной сыворотки была предложена противобруцеллезная абортная сыворотка с активностью 1000 ME в 1 мл. Эта стандартная сыворотка применяется для оценки результатов реакции агглютинации в международных единицах и для приготовления национальных стандартных сывороток и антигенов. Национальная стандартная сыворотка приготовляется бруцеллезным центром каждой страны. Определение количества международных единиц в сыворотке, предложенной как национальный стандарт, производится путем сравнения титра ее с титром международной стандартной сыворотки.
См. также Серологические исследования.
Библиография: Вершилова П. А., Чернышева М. И. и Князева Э. Н. Патогенез и иммунология бруцеллеза, М., 1974; Здродовски й П. Ф. Бруцеллез, с. 117, М:., 1953; Wright А. Е. а. Smith F. On the application of the serum test to the differential diagnosis of typhoid and Malta fever, Lancet, v. 1, p. 656, 1897.
E. И. Кайтмазова.
Для постановки реакции агглютинации на бруцеллёз применяют свежие сыворотки, взятые от исследуемых животных. Допускается исследование сыворотки, консервированной фенолом до 0,5% со сроком их давности не свыше 15 дней.
Реакцию ставят на физиологическом растворе (0,85 о/о) поваренной соли в четырёх разведениях: для свиней, коз, овец и собак 1 :25; 1 :50; 1 :100; 1 :200; для крупного рогатого скота, лошадей верблюдов 1 :50; 1 :100; 1 :200; 1 :400 в количестве 1 см3 каждого разведения, в пробирках с ровным выпуклым дном. При массовых исследованиях допускается постановка реакции в двух первых разведениях: для свиней, коз, овец и собак 1 :25 и 1 :50; для крупного рогатого скота, лошадей и верблюдов 1 :50 и 1 :100. Для предохранения от прорастания посторонней микрофлоры рекомендуется постановка реакции на фенолизированном 0,5 % физиологическом растворе.
Одновременно ставят следующие контроли: а) с отрицательной (негативной) сывороткой в тех же разведениях, как и испытуемые сыворотки, б) с положительной (позитивной) сывороткой до предельного её титра, в) антиген с 1 см3 физиологического раствора. Во все пробирки, в том числе и контроли, при постановке реакции микронипеткой вводят по 0,05 см3 антигена, содержащего в 1 см3 10 млрд. микробных тел. Затем все пробирки тщательно встряхивают до получения равномерной взвеси.
Допускается разлив сывороток в соответствующих дозах микропипеткой. В этом случае приливают по 1 см3 антигена, предварительно разведённого до 500 млн. микробных тел в 1 см3. Сыворотки разливают в дозах: 0,04; 0,02; 0,01 и 0,005, что соответствует разведениям: 1:25; 1:50; 1:100; 1:200. При разливе сывороток обязательна тщательная промывка пипеток после каждой сыворотки не менее шести раз в 2—3 посудах. После тщательного встряхивания, пробирки ставят на 4—10 часов в термостат при температуре 37—38° С, после чего их выдерживают при комнатной (16—18° С) температуре 18—24 часа и затем учитывают реакцию. Учёт реакции производят макроскопически.
Диагностически положительной испытуемая проба сыворотки считается при наличии макроскопической агглютинации в разведении 1:50 для свиней, овец, коз и собак и 1:100 для крупного рогатого скота, лошадей и верблюдов с оценкой их не менее, чем на два креста.
Диагностически сомнительной испытуемая проба сыворотки считается при наличии макроскопической агглютинации только в разведении I :25 для свиней, овец, коз, собак и 1 :50 для крупного рогатого скота, лошадей, верблюдов с оценкой не менее чем на два креста.
Все сыворотки, давшие агглютинацию в каких-либо разведениях исследуются повторно из той же пробы в четырёх разведениях: для свиней, овец, коз и собак 1:25; 1:50; 1:100; 1:200; для крупного рогатого скота, лошадей, верблюдов 1 :50; 1 :100; 1 :200; 1 :400. При получении сомнительной реакции кровь от животного берут повторно через 3—4 недели. При получении положительных или сомнительных реакций в отчёте хозяйству указывают разведение, в котором получена реакция.
Сыворотки крупного рогатого скота, поступившие из хозяйств, в которых имеются аборты на почве бруцеллёза или где реакцией агглютинации выделяется значительное количество положительно реагирующих на бруцеллёз (свежая инфекция), исследуются в четырех разведениях: 1:25; 1:50; 1:100; 1:200. При наличии, макроскопической агглютинации в разведениях 1 :25 или 1 :50 не менее чем на два креста, проба считается диагностически сомнительной. Если при повторном исследовании сомнительно реагирующих животных титр агглютинации не будет превышать 1 : 25, то проба признаётся диагностически отрицательной.
Если при исследовании сывороток свиней и лошадей будут получены только сомнительные реакции (у свиней 1 :25, у лошадей 1 :50) и при повторной проверке этих животных титр агглютинации не повысится, то при условии отсутствия в хозяйстве клинических признаков бруцеллёза среди этих видов животных и реагировавших в более высоких разведениях, пробы признаются диагностически отрицательными.
В благополучных по бруцеллёзу хозяйствах реакции в указанных разведениях считаются сомнительными.
Оценка реакции агглютинации в крестах следующая: ++++ — полное просветление жидкости при наличии явно выраженного зонтика (при встряхивании зонтик разбивается на хлопья, комочки, в крупинки). +++ те же явления, которые отмечаются для четырёх крестов, но жидкость слегка опалесцирует (недостаточно полное просветление). ++ — просветление жидкости выражено слабо. Имеется наличие зонтика, который при встряхивании разбивается на хлопья, комочки и крупинки.
+ — отсутствие или весьма незначительное просветление при наличии слабо выраженного зонтика или его следов. При встряхивании жидкости заметны комочки и крупинки.
— отрицательная реакция агглютинации. Отсутствие просветления и зонтика. Микробы могут оседать в виде точки—пункта; при встряхивании разбиваются в равномерную муть.
Схема учёта
| № п/п | Разведение сывороток | ||
| 1 : 50 | 1 1:100 | Диагностическая оценка | |
| 1 | — | — | Отрицат. |
| 2 | — | + | — |
| 3 | + | — | — |
| 4 | + | + | — |
| 5 | ++ | — | ± сомнит. |
| 6 | ++ | + | ± сомнит. |
| 7 | +++ | — | ± сомнит. |
| 8 | +++ | + | ± сомнит. |
| 9 | ++++ | — | ± сомнит. |
| 10 | ++++ | + | ± сомнит. |
| 11 | — | ++ | + положит. |
| 12 | + | ++ | + положит. |
| 13 | ++ | ++ | + « |
| И т. д. |
Метки: паратиф