Содержание
- Микробиологическая диагностика бруцеллеза.
- Микробиологическая диагностика бруцеллеза
- Выявление группы крови перед началом трансфузии
- Реакция Кумбса
- Непрямая и прямая реакция Кумбса
- Антиглобулиновая сыворотка
- Непрямой антиглобулиновый тест: выявление антигенов эритроцитов
- Реакция Кумбса: скрининг изоиммунных антиэритроцитарных антител
- Гемолитическая болезнь новорождённого
- Типы и причины проведения пробы Кумбса
- Типы проб Кумбса
- Процедура
Микробиологическая диагностика бруцеллеза.
Методы МБ диагностики бруцеллеза.
· К биологической пробе ( заражение морских свинок) прибегают в том случае, если материал сильно загрязнён посторонней микрофлорой и получить непосредственно из него чистую культуру возбудителя трудно. (Вводится морской свинке по 1.0 подкожно в паховую обл. Через 30 дней: Проба Бюрне, р-ия Райта, посев материала из органов и лимфатических узлов на питатетльные среды для выделения чистой культуры)
· Для диагностики бруцеллеза используются следующие серологические реакции:
А. Для обнаружения антител
1. Реакция Райта (титр антител определяют в международных единицах — МЕ. Диагностическое значение имеет титр антител более 200 МЕ/мл.
2. Реакция Кумбса (для определения неполных антител).
3. Ускоренные реакции: Хеддльсона, роз-бенгал, латекс-агглютинация, непрямая реакция гемолиза (эритроциты сенсибилизируют липополисахаридом бруцелл, добавляют сыворотку больного. Антиген соединяется с антителом и в присутствии комплемента происходит лизис эритроцитов), реакция иммунофлуоресценции (непрямой метод на предметном стекле).
4. Реакция пассивной гемагглютинации (РПГА).
5. Иммуноферментный метод (ИФМ – лунки сенсибилизируют антигеном).
6. Реакция связывания комплемента.
7. Опсоно-фагоцитарная реакция (ОФР) – прогностическое значение.
Б. Для обнаружения антигена
1. Реакция агрегат-гемагглютинации.
2. Иммуноферментный метод (луночки сенсибилизируют антителами к родоспецифическому антигену бруцелл).
3. РПГА с использованием эритроцитарного диагностикума с моноклональными антителами к родоспецифическому антигену бруцелл.
4. Реакция коагглютинации.
Кроме того, для быстрой диагностики бруцеллеза используют ПЦР.
· Аллергический — проба Бюрне
· Бактериологический.
От больного человека — кровь, костный мозг , моча (печеночный бульон + антифаговая сыворотка)
От больного животного — абортивный плод, околоплодная жидкость, кусочки некротизированной плаценты, моча, молоко, мясо (печеночный агар и бульон+ антифаговая сыворотка+ генциа-виолет)
Печеночный МПА + антифаговая сыворотка:
1)Биохимические тесты( активность уреазы, образование сероводорода. При необходимости др тесты.
2)Р-ия агглютинации со спец. сывороткой
3) Изучение отношения к Тбилиотическому бруцеллезному фагу
4)Изучение роста на средах с красителями
Серодиагностика бруцеллеза.
См. 23
Преимущества реакции Кумбса при серодиагностике бруцеллеза.
При помощи р-ии прямой и пассивной агглютинации определяют полные ( бивалентные) антитела. Неполные ( моновалентные, блокирующие) антитела не выявляются этими методами , так как, соединяясь с антигеном , блокируют его, но не могут вызвать аггрегации антигены в крупные конгломераты. Для выявления неполных антител используют спец. р-июКумбса. В р-ии участвуют : а)сыворотка больного в которой преобладают неполные антитела, б)антиген-диагностикум, в)антиглобулиновая сыворотка- антитела к человеческому глобулину.
Реакция протекает в 2 этапа:
1)взаимодействие антигена с неполными антителами
2)взаимодействие антиглобулиновой сыворотки с антителами, адсорбированными на антигене.
В силу того, что антиглобулиновые антитела двувалентны, они связывают 2 одновалентных антитела, адсорбированных соотвественно на 2 антигенах , что приводит к склеиванию антигенов, к их агглютинации.
Серологические экспресс-реакции для диагностики бруцеллеза.
Ускоренные реакции: Хеддльсона, роз-бенгал, латекс-агглютинация, непрямая реакция гемолиза (эритроциты сенсибилизируют липополисахаридом бруцелл, добавляют сыворотку больного. Антиген соединяется с антителом и в присутствии комплемента происходит лизис эритроцитов), реакция иммунофлуоресценции (непрямой метод на предметном стекле).
Реакция Хеддльсона и реакция Райта, их сущность.
1. Реакция Хеддльсона: На стекле размечают карандашом 4 квадрата размером 3×3 см каждый. Микропипеткой наносят в квадраты капли сыворотки объемом 0,04, 0,02 и 0,01 мл, в последний квадрат одну каплю (0,03 мл) физиологического раствора (контроль). В каждую каплю другой микропипеткой добавляют по 0,03 мл бруцеллезного диагностикума. Перемешивают капли стеклянной палочкой пли петлей, начиная с контрольной капли и идя от меньших количеств сыворотки к большим. Слегка подогревая и покачивая стекло, наблюдают за появлением агглютинации, которая должна наступать в течение 5 минут.
Оценка реакции: агглютинация только в первой капле – реакция сомнительная; агглютинация в первой и второй каплях – реакция положительная; агглютинация во всех трех каплях – реакция резко положительная.
Примечание: Реакция Хеддльсона имеет только скрининговое, ориентировочное значение. В случае ее положительного результата необходимо ставить более надежные серологические реакции (Райта, РПГА, ИФМ) и/или аллергическую пробу Бюрне.
Зарисовать реакцию Хеддльсона с указанием доз сыворотки в каждой капле.
2. Реакция Райта(ставится по классической схеме пробирочной реакции агглютинации (см. Часть I, занятие 16). Диагностический титр реакции Райта — 1:200): Наибольшую диагностическую ценность реакция агглютинации представляет при острой и подострой форме бруцеллеза. Отсутствие агглютинации во всех дозах сыворотки — реакция «отрицательная». Учет реакции проводят по стандарту мутности в зависимости от степени осаждения агглютината и просветления жидкости. Для приготовления стандарта мутности антиген, применяемый для постановки РА, еще раз разводят в два раза
Микробиологическая диагностика бруцеллеза
Возбудители бруцеллеза (Brucella melitensis, Brucella abortus, Brucella suis и Brucella canis) высоко контагиозны и работа с ними проводится в специализированных лабораториях особо опасных инфекций. Постановку серологических реакций и аллергических проб для диагностики бруцеллеза производят соответственно в обычных микробиологических лабораториях и больничных условиях.
Главным резервуаром бруцелл являются домашние сельскохозяйственные животные, а также другие виды животных, от которых человек заражается преимущественно контактным или контактно-бытовым, реже алиментарным путем. Клинические проявления бруцеллеза многообразны, поражаются лимфатическая, сосудистая, гепато-лиенальная системы и особенно опорно-двигательный аппарат Методы микробиологической диагностики бруцеллеза представлены в схеме 7.
Схема 7. Микробиологическая диагностика бруцеллеза
|
Материал: кровь, костный мозг, моча, испражнения, грудное молоко у кормящих женщин
|

 |

|
Генодиагностика. ПЦР
|
Серологический метод- постановка РА с сывороткой крови больного (реакция Райта, ставят в начале 2-й недели болезни, диагностический титр 1:200 и выше), ускоренной РА на стекле (реакция Хеддльсона), РСК и ИФА.
Диагностикумом в реакции Райта и Хеддльсона является взвесь убитых бруцелл с красителем генциановым фиолетовым или метиловым фиолетовым.
Реакцию агглютинации Хеддльсона ставят на стеклянной пластинке, на которую наносят микропипеткой неразведенную исследуемую сыворотку в количествах 0,08; 0,04; 0,02; 0,01 и 0,02 мл, добавляют по 0,03 мл бруцеллезного диагностикума, кроме последней дозы, в которую вносят 0,03 мл ФР (контроль сыворотки). Контролем диагностикума является смесь из 0,03 мл антигена и 0,03 мл ФР. Все капли перемешивают стеклянной палочкой или бактериологической петлей и после легкого покачивания стекла наблюдают за появлением мелкозернистого окрашенного агглютината. Отсутствие агглютинации во всех пробах сыворотки оценивается как отрицательная реакция, наличие агглютинации в 1-й пробе (0,08 мл сыворотки) — сомнительная, во 2-й (0,04 мл) — слабоположительная, в 3-й или 4-й пробах (0,02-0,01 мл) — положительная, во всех пробах — резко положительная реакция. Поскольку реакция агглютинации Хеддльсона иногда бывает положительной у здоровых людей за счет нормальных антител, она обязательно подтверждается реакцией Райта.
РИФ, РНГА, РСК и особенно ИФА более чувствительны, чем реакция агглютинации. Для ранней диагностики бруцеллеза особую ценность имеет ИФА, позволяющий выявить в сыворотке больных антибруцеллезные антитела класса IgM,которыев отличие от IgG появляются в ранние сроки болезни, свидетельствуя о свежем инфицировании.
Аллергический метод –постановка внутрикожной аллергической пробы Бюрне с 15-20 дня заболевания. Учет реакции проводится через 24-48 часов, положительной считается реакция в случае появления на месте введения аллергена (бруцеллина) болезненности, гиперемии и инфильтрации кожи диаметром 3 см и более. Положительная аллергическая реакция на бруцеллин сохраняется в течение длительного времени после перенесенного бруцеллеза, а также после прививки.
Бактериологический метод- посев крови для выделения гемокультуры в 2 флакона с 50 мл печеночного или асцитического бульона (рН 7,1-7,2) или МПБ с добавлением 1 % глюкозы, 2 % глицерина и антифаговой сыворотки (для инактивации бруцеллезного бактериофага) в первые дни болезни при наличии лихорадки. При отрицательных результатах исследование повторяют, т.к. бактериемия наблюдается в течение 1 года и более.
Один флакон выращивают в обычных аэробных условиях, другой — в герметично закрытом сосуде с 10 % углекислого газа (или СО2-инкубаторе) при температуре 370 С до 1 месяца, делая пересевы на скошенный печеночный агар или эритрит-агар каждые 4-5 дней. На жидких средах бруцеллы растут с образованием легкого помутнения и небольшого слизистого осадка, на плотных средах в виде округлых, диаметром до 5 мм, серовато-белых, блестящих, прозрачных с янтарным оттенком в проходящем свете колоний. Типичные колонии пересевают на скошенный агар и идентифицируют выделенную культуру до уровня вида.
Выполняются также посевы исследуемого материала в желток свежего куриного яйца или в желточный мешок куриного эмбриона с последующей их инкубацией в течение 5 дней при 370 С и пересевом содержимого желточного мешка на плотные и жидкие питательные среды для выделения чистой культуры бруцелл.
Бруцеллы идентифицируют на основании изучения морфологических (рис. 13 — грамотрицательные коккобактерии), культуральных, биохимических (они не ферментируют уг-
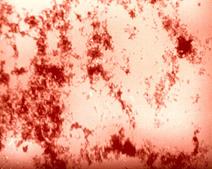
Рис. 13. Возбудитель бруцеллеза (Brucella melitensis). Окраска по Граму. Мелкие грамотрицательные коккобактерии.
леводы, не свертывают молоко и не разжижают желатину, выделяют сероводород), антигенных свойств (постановка РА с моноспецифическими сыворотками против антигеновА, М, R), чувствительности к специфическому бактериофагу и бактериостатическому действию анилиновых красителей (табл. 8).
Таблица 8.Дифференциация основных видов бруцелл
| Признак | Вид бруцелл | ||
| Br. melitensis | Br. abortus | Br. suis | |
| Условия культивирования | аэробные | 10% СО2 | аэробные |
| Рост на средах с красителями: | |||
| фуксином 1:50000 | + | + | — |
| тионином 1:25000 | + | — | + |
| пиронином 1:200000 | + | + | — |
| Образование Н2S | — | ± | ± |
| РА с монорецепторными сыворотками | |||
| А | ± | ± | + |
| М | ± | ± | ± |
| Чувствительность к бруцеллезному фагу | — | + | ± |
. Обозначения: «-» — отрицательная; «+» — положительная; «±» — непостоянная реакции.
Кровь представляет из себя жидкую ткань, которая состоит из тромбоцитов, эритроцитов, лейкоцитов и плазмы. Кровь играет важнейшую роль в функционировании человеческого организма, исполняя важные жизненные функции, и нередко применяется в медицинских целях. Допустим, во время значительный потери крови возникает потребность в трансфузии крови от донора реципиенту.
Выявление группы крови перед началом трансфузии
Сегоднятипирование крови осуществляется по антигенам эритроцитов, этому способствуют современные изосерологические исследования. Для этого обязательно делаются анализы на определение группы крови и резус-фактора по системе АВ0 и анализы на выявление совместимости крови реципиента и донора и иные анализы, в частности реакция Кумбса.
Для уменьшения риска для жизни больного проводят типирование крови, поскольку даже с одинаковыми группами крови, рецепиент и донор могут не совпадать по другим параметрам. После определения группы крови и резус-фактора, проводят анализ на совместимость – рецепиент и донор являются совместимыми, если в ходе анализа не случается агглютинации (склеивания эритроцитов) либо же гемолиза (разрушения эритроцитов).
Свести к минимуму угрозу для жизни больного позволяет как раз типирование крови. Перед трансфузией, помимо основных анализов, к примеру определение группы крови и резус-фактора, проводят много иных лабораторных исследований. Определение группы крови выступает важным анализом, который производится перед каждым хирургическим вмешательством, во время беременности, у новорожденных детей.
Реакция Кумбса
Для выявления гемолитической болезни у новорожденных детей и определения антител к резус-фактору у беременных женщин производится реакция Кумбса. Данный тест имеет огромное значение, так как резус-несовместимость матери и ребенка может способствовать гемолитической болезни ребёнка.
Непрямая и прямая реакция Кумбса
Тест Кумбса бывает прямой и непрямой, он протекает в один либо два этапа. В ходе проведения прямой реакции Кумбса антиглобулиновая сыворотка добавляется к сыворотке крови, с условием, что антитела зафиксировались на эритроцитах, и происходит агглютинация эритроцитов.
Если антитела находятся свободно в плазме крови проводится непрямой тест Кумбса. Для начала эритроциты и сыворотку крови инкубируют, чтобы закрепить антитела на эритроцитах. Затем добавляется антиглобулиновая сыворотка.
Антиглобулиновая сыворотка
Антиглобулиновую сыворотку используют для проведения реакции Кумбса – это реагент, имеющий антитела к иммуноглобулинам человека. Антиглобулиновая сыворотка еще используется в генетике, акушерстве, судебной медицине и других медицинских областях.
Выявление резус-принадлежности, определение аллоиммунных антиэритроцитарных антител, иммунных антител системы АВ0 — это еще не целый список возможностей применения антиглобулиновой сыворотки в медицине.
Реакция Кумбса – эффективный метод выявления антигенов эритроцитов и антиэритроцитарных антител крови человека в непрямой реакции агглютинации. Основа теста – использование при типировании антигенов эритроцитов специфических моноклональных реагентов на основе иммуноглобулинов класса G (IgG) с последующим применением на втором этапе реакции антиглобулиновой сыворотки Кумбса (АГС).
АГС производится путем смешивания сыворотки из крови лабораторных животных, иммунизированных иммуноглобулинами класса G человека, и моноклональных антител к одному из компонентов – C3D комплементу сыворотки человека. АГС вызывает агглютинацию эритроцитов, сенсибилизированных специфическими антителами. При отсутствии антител на эритроцитах под воздействием АГС положительная реакция не происходит.
Непрямая реакция Кумбса позволяет определить наличие:
- антигенов эритроцитов, выявляемых IgG-реагентами («неполными» антителами, например, моноклональными реагентами анти-D, анти-FYa, анти-FYb);
- антиэритроцитарных антител класса IgG.
Непрямой антиглобулиновый тест: выявление антигенов эритроцитов
Приводим методику непрямой реакции Кумбса на примере цоликлона анти-D IgG.
- Промаркируйте чистую пробирку: укажите ФИО исследуемого лица.
- Внесите в пробирку 2 капли (приблизительно 0,1 мл) цоликлона анти-D IgG.
- Добавьте 2 капли 5 % взвеси предварительно отмытых физиологическим раствором анализируемых эритроцитов. Смешайте исследуемые образцы с цоликлоном.
- Инкубируйте смесь на водяной бане или в термостате при 37 °С на протяжении 30 минут.
- Добавьте в пробирку пастеровской пипеткой 5 — 10 мл физраствора.
- Центрифугируйте пробирку с центробежным ускорением 1200 g при 18 – 25 °С на протяжении одной минуты.
- Удалите физраствор.
- Повторно проведите процедуру отмывки эритроцитов с помощью центрифугирования еще 2 – 3 раза.
- Добавьте 2 капли антиглобулиновой сыворотки к осадку кровяных телец, выполните перемешивание.
- Центрифугируйте пробирку с центробежным ускорением 1200 g в течение минуты при температуре 18 – 25 °С.
- Добавьте с помощью дозатора или пастеровской пипетки 3 – 5 капель физраствора.
- Ресуспендируйте осадок и визуально оцените наличие агглютинации. Выраженные агглютинаты на дне пробирки на фоне прозрачного раствора свидетельствуют об обнаружении антигена эритроцитов. Непрозрачная суспензия кровяных телец говорит об отсутствии антигена.
 маркировка пробирки
маркировка пробирки добавление цоликлона в пробирку
добавление цоликлона в пробирку отбор образца крови
отбор образца крови инкубация смеси в термостате
инкубация смеси в термостате центрифугирование пробирки
центрифугирование пробирки внесение антиглобулиновой сыворотки
внесение антиглобулиновой сыворотки агглютинаты на дне пробирки
агглютинаты на дне пробирки непрозрачная суспензия – отрицательный результат
непрозрачная суспензия – отрицательный результат
Реакция Кумбса: скрининг изоиммунных антиэритроцитарных антител
Исследование осуществляется в рамках проведения пробы на индивидуальную совместимость по всем антигенам эритроцитов крови донора и реципиента. Заключение о полной совместимости сыворотки реципиента с эритроцитами донора производят на основании отсутствия гемолиза и/или агглютинации на всех этапах проведения анализа. Признаки гемолиза и/или агглютинации на каком-либо этапе тестирования говорят о несовместимости образцов крови.
Оценка совместимости по системе АВ0, обнаружение «холодовых» антител
- Приготовьте образец крови донора:
- внесите в пробирку автоматическим дозатором 0,2 мл крови;
- 3 раза отмойте эритроциты в 5,0 мл физиологического раствора;
- ресуспендируйте осадок в 3 – 4 мл раствора с низкой ионной силой LISS.
- Промаркируйте вторую чистую пробирку: укажите ФИО реципиента и ФИО донора.
- Внесите автоматическим дозатором 0,1 мл сыворотки реципиента в промаркированную пробирку.
- Добавьте 2 капли 5 % суспензии эритроцитов в растворе LISS.
- Без промедления центрифугируйте смесь с центробежным ускорением 1200 g при температуре 18 – 25 °С на протяжении 15 – 20 секунд.
- Легким покачиванием пробирки отделите осадок от дна. Оцените наличие агглютинатов. Присутствие гемолиза и/или агглютинатов означает:
- несовместимость по системе АВ0;
- наличие в сыворотке больного «холодовых» антител класса IgM или IgА, не специфичных к антигенам АВ0.
Выявление «тепловых» антител
- При отсутствии гемолиза и/или агглютинатов инкубируйте пробирку 10 – 15 минут при 37 °С.
- Центрифугируйте пробирку при 1200 g на протяжении 15 – 20 секунд при комнатной температуре.
- Встряхните пробирку и проверьте наличие гемолиза и/или агглютинатов в супернатанте. Положительный результат говорит об обнаружении в сыворотке больного «тепловых» IgM-антител против антигенов эритроцитов донора.
Обнаружение IgG-антител в тесте Кумбса
- При отрицательном результате на прошлом этапе исследования добавьте в пробирку пастеровской пипеткой 5 мл 0,9 % раствора NaCl.
- Центрифугируйте пробирку при 1200 g на протяжении 15 – 20 секунд при температуре воздуха 18 – 25 °С. Пастеровской пипеткой аккуратно избавьтесь от супернатанта.
- Повторно выполните отмывание эритроцитов еще 2 – 3 раза.
- Добавьте в пробирку 1 – 2 капли антиглобулиновой сыворотки. Выполните тщательное перемешивание.
- Центрифугируйте пробирку при 1200 g 15 – 20 секунд.
- Аккуратно разбейте осадок эритроцитов и проведите визуальную оценку результата реакции. Выявление агглютинации означает присутствие в сыворотке больного IgG-антител против антигенов эритроцитов донора.
центрифугирование смеси выявление агглютинации
Гемолитическая болезнь новорождённого
Гемолитическая болезнь новорожденных является следствием изоиммунизации, вызванной несовместимостью крови матери и плода. В 80—85% случаев гемолитическая болезнь новорожденных — результат изоиммунизации по резус-фактору и в 20—15% случаев — по системе АВО.
Если женщина с резус-отрицательной кровью беременна плодом, унаследовавшим резус-положительную кровь отца, у нее может наступить сенсибилизация организма с образованием антирезус-аитител. Антитела во время беременности образуются не у всех женщин с резус-отрицательной кровью, а лишь у 15%.
Наиболе часто антитела образуются до наступления беременности в результате предшествовавших переливаний крови без учета резус-фактора. В образовании антител имеют значение проницаемость плацентарного барьера для эритроцитов плода и повторность беременностей.
Сенсибилизация при первой беременности наблюдается реже, чем при повторных беременностях. Но у ⅓ женщин без предварительных переливаний крови сенсибилизация наступает при первой беременности.
Сочетание резус-отрицательной крови у матери и резус-положительной крови у отца встречается в 13% случаев. При резус-конфликте возникает такой тип антител, которые соединяются с антигенами эритроцитов, не вызывая агглютинации.
Это скрытые агглютинирующие антитела; их называют еще блокирующими, или неполными, антителами. Ввиду того что неполные антитела имеют меньшую относительную молекулярную массу и легко проходят через плаценту, то возникновение гемолитической болезни связывают главным образом с этим типом антител.
Помимо этих антител, выделяют еще полные, агглютинирующие эритроциты (истинные агглютинины) и неполные, блокирующие.
Для обнаружения свободных антител в крови матери используется непрямая проба Кумбса, а для обнаружения фиксированных эритроцитами ребенка блокирующих антител — прямая проба Кумбса.
Сыворотка Кумбса получается путем иммунизации кроликов глобулином человека. Эритроциты ребенка, страдающего гемолитической болезнью, отмывают в солевом растворе, после чего к ним добавляют сыворотку Кумбса.
Прямая проба Кумбса оценивается по выраженности агглютинации эритроцитов одним или 2—4 крестами, а также отмечается время появления агглютинации: на 1—5-й минуте.
С целью профилактики гемолитической болезни новорожденных необходимо определять резус-принадлежность у всех беременных и исследовать их кровь на антитела. При появлении антител в крови матери во время беременности задолго до родов возникают наиболее тяжелые формы заболевания плода.
Клинические формы гемолитической болезни новорожденного: 1) универсальная водянка плода; 2) желтушная форма; 3) анемическая форма.
Приблизительно в 30% случаев заболевание, вызванное резус-несовместимостью, начинается еще во внутриутробном периоде. При тяжелых формах болезни возможна внутриутробная гибель плода. Плацента при наличии гемолитической болезни у плода увеличена, отечна.
У плода отмечаются очаги экстрамедуллярного гемопоэза и вследствие этого увеличение печени и селезенки. В крови новорожденного обнаруживаются эритробласты, поэтому заболевание носит также название эритробластоза.
Наиболее тяжелая форма гемолитической болезни — универсальная водянка плода, который при этом умирает или внутриутробно, или в процессе родов. Плод отечный, крупный, во всех полостях у него имеется отечная жидкость: гидроторакс, гидроперикардит, асцит; печень и селезенка резко увеличены, значительная желтуха с прокрашиванием подкорковых ядер мозга, значительный отек тканей мозга.
Желтушная форма гемолитической болезни наиболее часто встречается в сочетании с анемическим компонентом: у новорожденного вследствие изоиммуиизации происходит гемолиз с распадом эритроцитов и накоплением пигмента — билирубина.
В норме у здорового новорожденного содержание гемоглобина в пуповинной крови должно быть не ниже 90 единиц по Сали (150 г/л), а билирубина не выше 0,02—0,03 г/л.
Снижение уровня гемоглобина ниже 90 единиц и содержание билирубина выше 0,04 г/л в первые минуты жизни ребенка, имеющего резус-фактор в крови и рожденного женщиной с резус-отрицательной кровью, указывают на наличие гемолиза в крови.
Диагноз гемолитической болезни подтверждается иммунологическими исследованиями: определением резус-принадлежности плода прямой пробой Кумбса, проводимой с эритроцитами ребенка.
При содержании билирубина в сыворотке крови 0,04 г/л наступает желтушное окрашивание кожи; печень и селезенка у новорожденного с гемолитической болезнью увеличены, содержание гемоглобина ниже 90 единиц по Сали, в крови находят эритробласты — нормофильные, оксифильные; резус-фактор в крови обнаруживается, прямая реакция Кумбса положительная.
Наличие перечисленных выше признаков даст основание для установления диагноза гемолитической болезни.
Единственным надежным и эффективным методом лечения гемолитической болезни новорожденных является заменное переливание крови, которое производится тотчас после рождения ребенка.
Показаниями к первому заменному переливанию являются: увеличение содержания билирубина выше 0,04 г/л, снижение гемоглобина ниже 90 единиц по Сали (150 г/л), обнаружение резус-фактора в крови и положительная прямая проба Кумбса.
Заменное переливание крови осуществляется из расчета 180—200 мл донорской крови на I кг массы тела ребенка, т. е. 550—6Q0 мл крови на одну операцию. Для заменного переливания используется свежая резус-отрицательная кровь 0(1) группы или той же групы, что у ребенка, приготовленная по рецепту № 7.
Благодаря заменному переливанию из организма ребенка выводят резус-антитела, а оставшиеся антитела являются неопасными для введения в круг кровообращения резус-отрицательных эритроцитов донора.
Техника заменного переливания крови. В пупочную вену вводят эластический катетер и через него дробными порциями шприцем емкостью 20 мл выводят кровь ребенка и замещают ее кровью донора.
В последующие дни после рождения ребенка осуществляется контроль за содержанием билирубина и гемоглобина. При повышении уровня билирубина до 0,12 г/л на 2-е сутки и до 0,20 г/л на 3—5-е сутки осуществляется повторно обменное переливание крови.
С целью борьбы с билирубинемией 2—3 раза в сутки проводят внутривенные вливания плазмы и поливинилпирролидона (неокомпенсан) из расчета 10 мл/кг на одно вливание. В комплекс лечения гемолитической болезни входят преднизолон (1 мг/кг в сутки) и витамины группы В.
В комплексном лечении гемолитической болезни новорожденных применяются капельные вливания — внутривенные и виутрижелудоч-ные, производимые с помощью катетера, введенного в желудок, а также облучение ребенка светом лампы с длиной волны 42 нм.
При гемолитической болезни наблюдается анемия в период новорожденности в первом полугодии жизни. Для ее лечения проводят обычные терапевтические мероприятия.
Обменное переливание крови, внутривенное вливание плазмы и поливинил пиррол идона предотвращают билирубиновую интоксикацию мозга и прокрашивание подкорковых ядер.
У детей, которым не было вовремя произведено обменное переливание крови, могут быть тяжелые последствия, связанные с билирубиновой энцефалопатией, которая в дальнейшем выражается в хореатетозах и церебральных параличах.
Одна треть детей, страдающих церебральными параличами, перенесли гемолитическую болезнь и не получили своевременно правильного лечения.
Смертность новорожденных от гемолитической болезни стоит на 4-м месте после асфиксии, родовой травмы и врожденных уродств. Важно дифференцировать гемолитическую болезнь от физиологической желтухи новорожденных.
При гемолитической болезни по резус-фактору и системе АВО имеются иммунологические изменения, указывающие на наличке изоиммунизации по этим системам: различие резус-фактора и групповой принадлежности матери и плода, положительные иммунологические пробы с эритроцитами ребенка, указывающие на резус-сенсибилизацию (прямая проба Кумбса) или на групповую изосенсибилизацию (проба Розенфельда).
В крови матерей, у которых дети родились с гемолитической болезнью по резус-несовместимости, обнаруживают резус-антитела, в крови матери при АВО-несовместимости — групповые иммунные антитела в повышенном титре.
При дифференциальной диагностике гемолитической болезни и физиологической желтухи нужно помнить, что желтуха при гемолитической болезни наступает более рано — в 1—2-е сутки.
При атрезии желчных путей и паренхиматозном гепатите, который возникает при цитомегалии, содержание прямого билирубина (диглюкуронид и моноглюкуронид) в крови также повышено, поэтому для дифференциального диагноза необходимо фракционное определение билирубина.
Типы и причины проведения пробы Кумбса
Проба Кумбса – это клинический анализ крови, который проводится, чтобы выявить, содержит ли кровь определенные антитела, которые могут быть небезопасны. Эти антитела приклеиваются к эритроцитам и могут вторгнуться в иммунную систему, а также нанести вред другими способами. В медицинской терминологии это исследование также называют антиглобулиновым тестом (АГТ).
Типы проб Кумбса
Существует два типа проб Кумбса – прямой и непрямой.
Прямая проба Кумбса, также известная как прямой антиглобулиновый тест (ПАТ), выявляет ауто-антитела, которые прикрепляются к поверхности эритроцитов. Эти антитела иногда производятся в организме вследствие определенных заболеваний или при приеме определенных медикаментов, таких как прокаинамид, метилдопа или хинидин.
Данные антитела опасны, потому что иногда они вызывают анемию, разрушая эритроциты.
Данный тест иногда назначается для диагностики причины желтухи или анемии.
В норме реакция Кумбса отрицательная.
Положительно при:
- гемолитической болезни новорожденных;
- аутоиммунном гемолизе;
- гемолитических трансфузионных реакциях;
- лекарственной иммунной гемолитической анемии.
Непрямая проба Кумбса, также известная как непрямой антиглобулиновый тест (НАТ), используется для обнаружения антител к эритроцитам, содержащимся в сыворотке крови (сыворотка – это прозрачная желтая жидкость крови, которая остается после того, как выводятся красные кровяные тельца и коагулянт).
Непрямая проба Кумбса применяется при переливании крови для определения того, совпадает ли кровь донора с кровью реципиента. Это называется пробой на совместимость, она помогает предотвратить любую неблагоприятную реакцию на кровь донора. Данный анализ также рекомендован беременным женщинам. Некоторые женщины имеют антитела класса IgG, которые могут проникать через плаценту в кровь плода и нанести вред новорожденному, вызвав гемолитическое заболевание, известное как гемолитическая анемия.
Процедура
Кровь берется посредством шприца из вены, обычно с тыльной стороны ладони или на сгибе локтя. Место прокола пред этим тщательно дезинфицируется, а после взятия анализа крови накладывается чистая марля или вата.
Полученная кровь очищается в лаборатории, при этом отделяются красные кровяные тельца. Образец затем последовательно исследуется с применением различных реагентов сыворотки и Кумбса, который противопоставляется глобулину человека. Если не случается агглютинации (слипания красных кровяных телец), это означает положительный результат.
Однако если тест отрицательный, это означает, что в крови имеются антитела, которые действуют против эритроцитов. Это может указывать на различные заболевания, такие как анемия (как естественная, так и спровоцированная приемом медикаментов), лейкемия, сифилис, системная волчанка или микоплазменная инфекция. После получения результатов лечащий врач назначит соответствующее лечение.