Содержание
- Методические указания по контролю работы паровых и воздушных стерилизаторов
- 1. Общие положения
- 2. Физический метод контроля
- 3. Химический метод контроля
- Контроль за качеством стерилизации в паровых медицинских стерилизаторах
- Рабочий температурный режим стерилизатора
- Контроль параметров работы стерилизатора
- Cанитарно-эпидемиологический режим в стерилизационной
- Продукция / Контроль стерилизации / Индикаторы химические / Контроль паровой стерилизации / Тест-пакет «Бови-Дик-ВИНАР»
- Контроль паровой и воздушной стерилизации медицинских изделий химическими индикаторами однократного применения производства НПФ «ВИНАР», г.Москва. Методические рекомендации
- 1. ОБЛАСТЬ ПРИМЕНЕНИЯ
- 2. ОБЩИЕ ПОЛОЖЕНИЯ
- 3. МЕТОДОЛОГИЧЕСКИЕ ОСНОВЫ КОНТРОЛЯ СТЕРИЛИЗАЦИИ С ПОМОЩЬЮ ХИМИЧЕСКИХ ИНДИКАТОРОВ
- 4. ИНДИКАТОРЫ ПАРОВОЙ СТЕРИЛИЗАЦИИ
- Контроль стерилизации
- Центральное стерилизационное отделение в лпу (цсо).
- Стерилизация, определение, методы, контроль качества
- Методы стерилизации
- Контроль эффективности стерилизации
Методические указания по контролю работы паровых и воздушных стерилизаторов
УТВЕРЖДАЮ
Начальник Главного
эпидемиологического управления
Министерства здравоохранения СССР
М.И.Наркевич
28 февраля 1991 года N 15/6-5
1. Общие положения
1. Общие положения
1.1. Методические указания предназначены для персонала дезинфекционных и санитарно-эпидемиологических станций, а также персонала лечебно-профилактических учреждений (ЛПУ), осуществляющих контроль работы паровых и воздушных стерилизаторов.
1.2. Контроль осуществляют физическим, химическим и бактериологическим методами. Для контроля используют средства измерения температуры, давления, времени, химические тесты, термохимические индикаторы и биотесты.
1.3. Физический и химический методы контроля являются методами оперативного контроля параметров режимов работы паровых и воздушных стерилизаторов (температура стерилизации, давление, время стерилизационной выдержки), результаты которого учитывают в процессе стерилизационного цикла или сразу после его окончания (максимальная температура, достигнутая в ходе стерилизационного цикла). Бактериологический метод контроля позволяет контролировать эффективность работы стерилизатора.
1.4. Контроль работы стерилизаторов в ЛПУ включает контроль после монтажа и ремонта аппарата и контроль в процессе его эксплуатации. Последний подразделяют на плановый контроль, самоконтроль и контроль по показаниям, который проводят при получении неудовлетворительных результатов контроля стерильности изделий медицинского назначения, неудовлетворительных результатов физического, химического и бактериологического контроля.
1.5. В функции персонала дезинфекционных станций и дезинфекционных отделов (отделений) санитарно-эпидемиологических станций входит контроль работы стерилизатора после монтажа и ремонта, плановый контроль, а также контроль по показаниям при обнаружении неудовлетворительных результатов контроля стерильности изделий медицинского назначения.
1.6. В функции персонала ЛПУ входит самоконтроль работы аппаратов и контроль по показаниям при получении неудовлетворительных результатов физического и химического контроля, неудовлетворительных результатов контроля стерильности изделий медицинского назначения.
1.7. Контроль работы стерилизатора после монтажа и ремонта аппарата, плановый контроль и контроль по показаниям, проводимый персоналом дезинфекционных станций, дезинфекционных отделов (отделений) санитарно-эпидемиологических станций, осуществляют физическим, химическим и бактериологическим методами. Самоконтроль работы аппаратов и контроль по показаниям, проводимый персоналом ЛПУ, осуществляют физическим и химическим методами.
1.8. Плановый контроль работы всех стерилизаторов в объектах надзора проводят в порядке государственного санитарного надзора не реже 2 раз в год. Самоконтроль работы стерилизатора проводят при каждой загрузке аппарата.
1.9. При проведении контроля контрольные тесты (максимальные термометры, химические тесты, термохимические индикаторы и биотесты упаковывают вместе в пакеты из упаковочной бумаги (ОСТ 42-21-2-85), нумеруют и размещают по схеме в контрольные точки паровых (приложение 1) и воздушных (приложение 2) стерилизаторов.
1.10. При проведении контроля персоналом дезинфекционных станций и дезинфекционных отделов (отделений) санитарно-эпидемиологических станций протокол контроля работы стерилизатора составляют в двух экземплярах. Один экземпляр направляют главному врачу ЛПУ после получения результатов бактериологического контроля.
1.10.1. Изделия медицинского назначения без индивидуальной упаковки, стерилизовавшиеся в стерилизационных коробках, в которые закладывали средства контроля, подлежат повторной стерилизации после их извлечения.
1.10.2. При контроле объекта надзора проверяют оснащенность ЛПУ стерилизационным оборудованием и средствами контроля, санитарное состояние помещения стерилизационной, знание и практические навыки персонала в обслуживании аппаратов, наличие необходимой документации.
1.11. При осуществлении самоконтроля работы аппаратов персонал, обслуживающий стерилизатор, закладывает максимальные термометры (раздел 2), химические тесты и термохимические индикаторы (раздел 3) в стерилизационную камеру, следит на протяжении цикла стерилизации за показаниями контрольно-измерительных приборов, оценивает результаты контроля и дает заключение о возможности выдачи простерилизованных изделий.
1.11.1. Медицинский персонал, использующий стерилизованные изделия, закладывает химические тесты и термохимические индикаторы (раздел 3) в стерилизационные коробки или внутрь стерилизуемых упаковок, оценивает результаты контроля и принимает решение о возможности использования простерилизованных изделий.
1.11.2. Персонал, обслуживающий стерилизационное оборудование, регистрирует этапы процесса стерилизации и результаты физического и химического контроля в журнале, пронумерованном, прошнурованном и скрепленном печатью медицинского учреждения. Форма журнала в соответствии с формой 257/у, утв. МЗ СССР N 1039 от 04.10.89.
1.11.3. Ответственность за организацию стерилизационных мероприятий в ЛПУ, включая организацию самоконтроля работы стерилизационной аппаратуры, возлагается на главного врача данного учреждения.
1.12. Загрузка паровых и воздушных стерилизаторов при всех видах контроля регламентирована Методическими рекомендациями по организации централизованных стерилизационных в лечебно-профилактических учреждениях, утв. МЗ СССР N 15-6/8 от 31.01.91.
2. Физический метод контроля
2.1. Физический метод контроля предназначен для оперативного контроля параметров режимов работы паровых и воздушных стерилизаторов (температура стерилизации, давление, время стерилизационной выдержки). Результаты контроля позволяют оперативно выявить неисправность аппарата и контрольно-измерительных приборов и ориентировочно оценить правильность загрузки стерилизатора в каждом конкретном случае.
2.2. Физический метод контроля работы стерилизаторов осуществляют с помощью средств измерения температуры (термометр, термометр максимальный), давления (мановакуумметр) и времени (секундомер, часы).
2.3. Параметры режима работы стерилизатора следует проверять в течение цикла стерилизации, проводимого в соответствии с паспортом на аппарат.
2.4. Контроль параметров режимов работы паровых стерилизаторов:
2.4.1. Контроль температурного параметра режимов работы паровых стерилизаторов осуществляют с использованием термометра ртутного стеклянного максимального с диапазоном измерения от 0 до 150°С (ТП-7). Погрешность измерения не должна превышать ±1°С.
Упакованные термометры (п.1.9) нумеруют и размещают в контрольные точки 1 и 2 камеры паровых стерилизаторов в соответствии с прил.1.
По окончании цикла стерилизации регистрируют показания термометров и сопоставляют их между собой, а также с номинальной температурой стерилизации.
Отклонения в показаниях максимальных термометров допускаются в пределах, регламентированных ОСТ 42-21-2-85.
2.4.2. Давление в стерилизационной камере парового стерилизатора измеряют при помощи мановакуумметра. Класс точности мановакуумметра должен быть не ниже 2,5. Предел измерения от 0,1 до 0,5 МПа (от 1 до 5 кгс/кв.см).
Установку давления на манометре парового стерилизатора, соответствующего заданной температуре стерилизации, проводят согласно прил.3.
2.4.3. Ежедневно перед началом рабочей смены проводят контроль герметичности камеры стерилизатора, снабженного вакуумным насосом, по следующей методике:
Для контроля герметичности в рабочей камере создают максимально возможное разрежение. При выключенном вакуумнасосе давление в камере не должно изменяться в течение времени, которое предусмотрено инструкцией по эксплуатации для сушки материалов после стерилизации. Повышение давления в камере более 0,005 МПа (0,05 кгс/кв.см) указывает на подсос воздуха.
2.4.4. Хронометраж цикла стерилизации проводят с помощью механического секундомера по ГОСТ 5072-79, класс точности 2,0 или часов наручных механических с погрешностью суточного хода ±1 минута.
2.5. Контроль параметров режимов работы воздушных стерилизаторов.
2.5.1. Контроль температурного параметра режимов работы воздушных стерилизаторов в течение цикла стерилизации проводят путем наблюдения за показаниями приборов, установленных на стерилизаторе (термометр, индикаторные устройства на панели аппарата).
2.5.2. Распределение температур внутри загруженной стерилизационной камеры проводят с использованием термометра ртутного стеклянного максимального с диапазоном измерения от 0 до 200°С (ТП-25). Погрешность измерения температуры не должна превышать ±1°С.
Упакованные максимальные термометры (п.1.9) нумеруют и размещают в контрольные точки камеры воздушных стерилизаторов в соответствии с прил.2.
По окончании цикла стерилизации регистрируют показания термометров и сопоставляют их с номинальной температурой стерилизации.
Отклонения в показаниях максимальных термометров допускаются в пределах, регламентированных ОСТ 42-21-2-85.
2.5.3. Хронометраж цикла стерилизации проводят аналогично п.2.4.4.
2.6. Периодически и по показаниям персонал проводит самоконтроль работы паровых и воздушных стерилизаторов по методике с прерванным циклом стерилизации, которая позволяет оценить температурные параметры режимов работы стерилизаторов в процессе стерилизационного цикла с использованием максимальных термометров и химических тестов.
2.6.1. Самоконтроль работы паровых стерилизаторов проводят по следующей методике: упакованные максимальные термометры (п.1.9) нумеруют и размещают в контрольные точки паровых стерилизаторов в соответствии с прил.1. Работу парового стерилизатора прекращают через 7 минут стерилизационной выдержки.
Оценку показаний максимальных термометров проводят аналогично п.2.4.1.
Методика самоконтроля паровых стерилизаторов с использованием химических тестов изложена в п.3.3.5.1.
2.6.2. Самоконтроль работы воздушных стерилизаторов проводят по следующей методике: упакованные максимальные термометры (п.1.9) нумеруют и размещают в контрольные точки воздушных стерилизаторов в соответствии с прил.2.
Работу воздушного стерилизатора прекращают через 30 минут стерилизационной выдержки.
Оценку показаний максимальных термометров проводят аналогично п.2.5.2.
Методика самоконтроля работы воздушных стерилизаторов с использованием химических тестов изложена в п.3.3.5.2.
2.7. Правильность показаний термометров перед проведением контроля проверяют путем погружения их в кипящую воду в открытом сосуде на 6-7 минут (ртутный шарик термометра не должен касаться стенок сосуда с водой). Если термометры показывают температуру 100±1°С, их считают исправными.
2.8. При обнаружении неудовлетворительных результатов контроля в процессе стерилизационного цикла и после его окончания загрузку считают непростерилизованной. Аппарат прекращают использовать, анализируют правильность осуществления требуемого режима стерилизации, правильность загрузки и исправность аппарата. При обнаружении неисправности специально выделенное лицо, ответственное за проведение стерилизации медицинского инструментария, вызывает представителя ПО «Медтехника» для ее устранения.
Стерилизатор разрешают использовать после устранения причин неудовлетворительной работы стерилизатора и получения удовлетворительных результатов контроля.
3. Химический метод контроля
3.1. Химический метод контроля предназначен для оперативного контроля одного или в совокупности нескольких параметров режимов работы паровых и воздушных стерилизаторов.
3.2. Химический метод контроля работы стерилизаторов осуществляют с помощью химических тестов и термохимических индикаторов.
3.3. Химический тест представляет запаянную с обоих концов стеклянную трубку, заполненную смесью химического соединения с органическим красителем или только химическим соединением (веществом), изменяющим свое агрегатное состояние и цвет при достижении определенной для него температуры плавления.
3.3.1. В таблицах 1 и 2 представлен перечень соединений, рекомендуемых для изготовления химических тестов, и рецептуры химических тестов. Подбор химических соединений проведен с учетом минимально допустимых температур используемых режимов стерилизации, регламентированных ОСТ 42-21-2-85.
3.3.2. Упакованные химические тесты (п.1.9) нумеруют и размещают в контрольные точки паровых (прил.1) и воздушных (прил.2) стерилизаторов.
3.3.3. По окончании стерилизации химические тесты вынимают из стерилизатора и визуально определяют изменение их агрегатного состояния и цвета.
3.3.3.1. При удовлетворительном результате контроля химические тесты должны равномерно расплавиться и изменить цвет, что свидетельствует о достижении заданной температуры стерилизации.
3.3.3.2. При неудовлетворительном результате контроля равномерное расплавление и изменение цвета химических тестов отсутствует, т.е. заданная температура стерилизации не была достигнута.
3.3.4. При обнаружении неудовлетворительных результатов химического контроля поступают, как указано в п.2.8.
3.3.5. Самоконтроль работы паровых и воздушных стерилизаторов с использованием химических тестов.
Таблица 1
Рецептуры химических тестов для контроля температурных параметров режимов работы паровых стерилизаторов
|
N рецеп- |
Наименование составных частей |
Цвет, форма кристаллов, запах |
Нормативно- техническая документация |
Количество компонента, г |
Температурный параметр, подлежащий контролю °С |
||
|
110+2 |
120+2 |
1322 |
|||||
|
Антипирин |
Бесцветные кристаллы или |
ГФ X, с.65 |
99,90,01 |
+ |
|||
|
Краситель |
|||||||
|
Фуксин кислый |
ТУ 6-09-3803-82 |
||||||
|
или |
|||||||
|
Феноловый |
ТУ 6-09-5170-84 |
||||||
|
красный или |
|||||||
|
Бромтимоловый |
ТУ 6-09-2086-77 |
||||||
|
синий или |
|||||||
|
Генциано-фиолетовый |
|||||||
|
________________ |
|||||||
|
Резорцин |
Белый или со слабым желто- |
ГФ X, ст.577 |
99,90,01 |
+ |
|||
|
Краситель |
0,10,01 |
||||||
|
Сера |
Желтые |
ТУ 6-09-2546-77 |
100,0 |
+ |
|||
|
элементарная |
кристаллы |
||||||
|
Кислота бензойная |
Бесцветные игольчатые кристаллы или белый порошок |
ГФ X, с.9 |
95,24+0,01 |
||||
|
Краситель |
4,76+0,01 |
||||||
|
Кислота бензойная |
Бесцветные игольчатые кристаллы или белый порошок |
ГОСТ 6413-77 |
99,90,01 |
||||
|
Краситель |
0,10,01 |
||||||
|
Д (+) — Манноза |
Бесцветные кристаллы в виде ромбических |
ТУ 6-09-07-666-76 |
99,90,01 |
+ |
|||
|
Краситель |
0,10,01 |
||||||
|
Никотинамид |
Белый кристал- |
Гф X, с.452 ТУ |
99,90,01 |
+ |
|||
|
Краситель |
0,10,01 |
||||||
|
Мочевина |
Бесцветные кристаллы |
ГОСТ 6691-77 |
95,240,01 |
+ |
|||
|
Краситель |
4,760,01 |
||||||
Примечание:
— относится к сильнодействующим лекарственным средствам, применение и хранение которых должно проводиться с предосторожностью: хранение в закрытых шкафах, в сухом помещении.
— ГФ Х — Государственная фармакопея СССР, Х издание.
— «+» — температурный параметр, для контроля которого используют химическое соединение.
— используют любой из красителей, перечисленных в рецептуре 1.
— при использовании серы в качестве химического теста добавление красителя нецелесообразно, так как при плавлении вещества не происходит его смешение с красителем.
3.3.5.1. Самоконтроль работы паровых стерилизаторов (п.2.6.1) проводят по следующей методике: упакованные химические тесты (п.1.9) нумеруют и размещают в контрольные точки паровых стерилизаторов в соответствии с прил.1. Работу парового стерилизатора прекращают через 7 минут стерилизационной выдержки.
Оценку показаний химических тестов проводят аналогично п.3.3.3.
3.3.5.2. Самоконтроль работы воздушных стерилизаторов (п.2.6.2) проводят по следующей методике: упакованные химические тесты (п.1.9) нумеруют и размещают в контрольные точки воздушных стерилизаторов в соответствии с приложением 2. Работу воздушного стерилизатора прекращают через 30 минут стерилизационной выдержки.
Таблица 2
Химические тесты для контроля температурных параметров режимов работы воздушных стерилизаторов
|
N п/п |
Наименование химического соединения |
Цвет, форма кристаллов, запах |
Нормативно-техническая документация |
Коли- |
Температурный параметр, подлежащий контролю, °С |
|
|
+2 |
||||||
Контроль за качеством стерилизации в паровых медицинских стерилизаторах
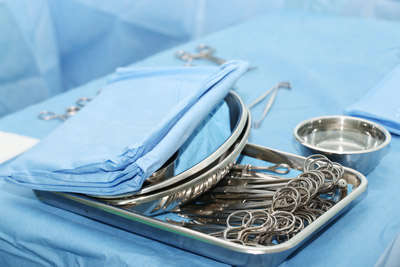 При каждом включении стерилизатора или запуске цикла стерилизации проводите текущий контроль. Он нужен для проверки параметров, критичных для стерилизации. К ним относятся: давление, температурный и временной режимы работы аппарата; полнота удаления воздуха из стерилизационной камеры; качество сушки ИМН в стерилизаторе.
При каждом включении стерилизатора или запуске цикла стерилизации проводите текущий контроль. Он нужен для проверки параметров, критичных для стерилизации. К ним относятся: давление, температурный и временной режимы работы аппарата; полнота удаления воздуха из стерилизационной камеры; качество сушки ИМН в стерилизаторе.
Особенности выбора упаковки для стерилизации медизделийскачать / открыть памятку >>
В рекомендации рассказали, как проконтролировать качество стерилизации при работе с медицинским паровым стерилизатором.
Содержание рекомендации
- Рабочий температурный режим стерилизатора
- Контроль параметров работы стерилизатора
- Cанитарно-эпидемиологический режим в стерилизационной
Рабочий температурный режим стерилизатора
Паровые стерилизаторы должны обеспечивать в любой трудностерилизуемой точке загрузки температуру:
- 121 °С в течение 15 мин;
- 126 °С в течение 10 мин;
- 134 °С в течение 3 мин.
Выполнение этих условий необходимо для достижения высокого уровня стерильности – SAL = 10-6. Это означает, что вероятность оставить какой-то участок медизделия нестерильным после обработки составляет 1 к 1 000 000.
Контроль параметров работы стерилизатора
Чтобы проконтролировать параметры работы стерилизатора, используйте наружные и внутренние химические индикаторы. Наружные индикаторы прикрепите внутри стерилизационной камеры, внутренние – в упаковку с ИМН и в труднодоступные места медизделий. Все индикаторы меняют цвет в зависимости от температуры воздействия и давления пара.
«Индикаторы-свидетели» крепят на каждую упаковку с ИМН, чтобы отличить простерилизованные медизделия от контаминированных. При стерилизации «свидетели» необратимо меняют цвет.
Методы текущего контроля описаны в приложении 3 к МУ-287-113 от 30 декабря 1998 г. и МУ от 28 февраля 1991 г. № 15/6-5. Классификация химических индикаторов приведена в разделе 4 ГОСТ ISO 11140-1-2011, биологические индикаторы описаны в ГОСТ ISO 11138-1-2012.
Периодический контроль проводите в зависимости от сроков эксплуатации оборудования и конкретной ситуации, но не реже, чем указано в таблице.
Открыть таблицу >>
Методы периодического контроля описаны в главе 2 МУ от 31 января 1994 г. № 11-16/03-03. Метод контроля за полнотой удаления воздуха из стерилизационной камеры описан в главе 3 МУК 4.2.1990-05.
Cанитарно-эпидемиологический режим в стерилизационной
Контроль за стерилизацией включает в себя и соблюдение санитарно-эпидемиологического режима в стерилизационной. Для этого составьте план проверок. Включите в него контроль за качеством и периодичностью влажной уборки и дезинфекции помещений и оборудования; своевременностью смены фильтров в приточной вентиляции стерильных и чистых помещений и в стерилизационных коробках и системе подачи воздуха в стерилизационную камеру.
Также проверяйте, соответствует ли одежда и обувь персонала требованиям, предъявляемым к асептическому производству. Контролируйте, соблюдают ли медработники правила хранения и транспортировки стерильных ИМН. Утвердите план-график проверки у главврача.
Приказ об организации надзора и обеспечении безопасной эксплуатации стерилизаторов медицинских паровых

В полной версии рекомендации рассказали, что делать старшей медсестре, если в одном из микробиологических тестов обнаружен рост культуры микроорганизмов, разъяснили особенности упаковки медизделий для паровой стерилизации, рассказали о принципах обучения медперсонала работе со стерилизатором.
Развернуть рекомендацию полностью >>
 |
Как составить пятилетний график обучения: рекомендация Минздравасохранить файл >> Состав аптечки «АнтиВИЧ» – памяткасохранить файл >> План по зарплатам медиков-2020: доклад Скворцовойсохранить файл >> |
 |
Подписывайтесь на наш канал в Яндекс.Дзен |
Материал проверен экспертами Актион Медицина
Продукция / Контроль стерилизации / Индикаторы химические / Контроль паровой стерилизации / Тест-пакет «Бови-Дик-ВИНАР»
- Экспресс-контроль дезинфекции
- Предстерилизационная очистка
- Упаковочные материалы для стерилизации
- Контроль стерилизации
- Устройства контроля процесса
- Контроль условий хранения и транспортирования ИЛП
- Контроль продуктов питания
- Отчётная документация
Контроль паровой и воздушной стерилизации медицинских изделий химическими индикаторами однократного применения производства НПФ «ВИНАР», г.Москва. Методические рекомендации
Методические рекомендации
Контроль паровой и воздушной стерилизации медицинских изделий химическими индикаторами однократного применения производства НПФ «ВИНАР», г.Москва
1. РАЗРАБОТАНЫ Научно-исследовательским институтом дезинфектологии МЗ РФ (Абрамова И.М., Дьяков В.В.), Департаментом Госсанэпиднадзора МЗ РФ (Бойко Л.С.), Научно-производственной фирмой «ВИНАР» (Иванов С.М., Андреев В.С., Червякова Н.Е.)
2. УТВЕРЖДЕНЫ Руководителем Департамента Госсанэпиднадзора Министерства здравоохранения Российской Федерации С.И.Ивановым 23 марта 2004 г. N 11-3/7-09
3. ВВЕДЕНЫ ВПЕРВЫЕ
СОГЛАСОВАНО
Директор НИИ дезинфектологии Минздрава России академик РАМН М.Г.Шандала 10 февраля 2004 г.
Генеральный директор НПФ «ВИНАР» В.С.Андреев 8 февраля 2004 г.
Методические рекомендации предназначены для персонала лечебно-профилактических учреждений (ЛПУ), работников дезинфекционной и санитарно-эпидемиологической служб, а также других учреждений, имеющих право осуществлять дезинфекционную деятельность.
1. ОБЛАСТЬ ПРИМЕНЕНИЯ
1. ОБЛАСТЬ ПРИМЕНЕНИЯ
1.1. Методические рекомендации распространяются на контроль воздушной и паровой стерилизации медицинских изделий, стерилизуемых в соответствии с «Методическими указаниями по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» от 30.12.98 г. N МУ 287-113 (далее — МУ 287-113).
1.2. Методические рекомендации распространяются на химические индикаторы контроля стерилизации, разработанные и производимые НПФ «ВИНАР», зарегистрированные в установленном порядке Минздравом России (далее — индикаторы).
1.3. Методические рекомендации не распространяются:
— на контроль стерилизации жидких лекарственных и иных средств в укупоренных сосудах;
— на контроль стерилизации, проводимой при режимах, отличающихся от указанных в МУ 287-113.
2. ОБЩИЕ ПОЛОЖЕНИЯ
2.1. В методических рекомендациях использованы термины, сведения и современные подходы к контролю стерилизации, изложенные в российских и международных стандартах ГОСТ Р ИСО 11140, 11138, 11134, 13683, ИСО 14161* и EN 285 (ГОСТ Р 51685). Методические рекомендации разработаны в развитие МУ 287-113 с учетом опыта их практического применения и современных сведений о контроле стерилизации.
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить перейдя по ссылке на сайт http://shop.cntd.ru. — Примечание изготовителя базы данных.
2.2. Методические рекомендации определяют действия персонала при контроле условий стерилизации с учетом типа индикатора, особенностей стерилизационного оборудования, вида стерилизуемых изделий.
2.3. Методические рекомендации не заменяют инструкции по применению индикаторов конкретного вида и должны использоваться совместно с ними.
2.4. Методические рекомендации позволяют осуществить системный подход к контролю стерилизации с учетом особенностей стерилизационного оборудования, вида стерилизуемых изделий и материальных возможностей лечебных учреждений.
2.5. Описываемые в методических рекомендациях индикаторы зарегистрированы в установленном порядке Министерством здравоохранения Российской Федерации.
2.6. Описываемые в методических рекомендациях индикаторы по классификации ГОСТ Р ИСО 11140-1* «Стерилизация медицинской продукции. Химические индикаторы. Часть 1. Общие требования» относятся к классу 1 (индикаторы процесса, или «свидетели»: индикаторы серий ИСПС, ИСВС), к классу 4 (многопараметрические индикаторы: индикаторы серий ИС, СТЕРИКОНТ-П и СТЕРИКОНТ-В, СТЕРИТЕСТ-П, ИНТЕСТ-П, МедИС и МедИС-В) и к классу 5 (интегрирующие индикаторы серии СТЕРИТЕСТ-В).
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р ИСО 11140-1-2009, здесь и далее по тексту. — Примечание изготовителя базы данных.
2.7. Индикаторы достигают конечного состояния, необратимо меняя цвет индикаторной метки, при обеспечении определенных условий воздействия стерилизующего агента в цикле стерилизации, соответствующих контрольным значениям индикатора или превышающих их.
2.8. Индикаторы можно использовать в качестве документа архива и подклеивать в рабочие журналы контроля работы стерилизаторов (форма 257/у, приказ МЗ N 1030 от 04.10.80 г.).
3. МЕТОДОЛОГИЧЕСКИЕ ОСНОВЫ КОНТРОЛЯ СТЕРИЛИЗАЦИИ С ПОМОЩЬЮ ХИМИЧЕСКИХ ИНДИКАТОРОВ
3.1. Стерилизация является примером так называемого специального процесса, поскольку ее положительный результат не может быть полностью и гарантированно проверен последующим испытанием продукции. Поэтому процесс стерилизации должен быть валидирован (аттестован) до практического применения и подлежит текущему контролю, а оборудование — необходимому обслуживанию.
3.2. Процесс гибели микроорганизмов при стерилизации описывается экспоненциальным законом. По этой причине нельзя гарантировать полное отсутствие выживших микроорганизмов в изделии после стерилизации, а можно говорить только о вероятности наличия микроорганизмов. Эта вероятность может быть очень малой, но она никогда не может быть равна нулю. Вероятность может быть выражена в виде уровня обеспечения стерильности (10). Текущий и периодический контроль стерилизации, наряду с валидацией, призван повысить надежность стерилизации и уменьшить вероятность того, что после стерилизационной обработки изделия останутся нестерильными.
3.3. Для повышения надежности стерилизации химический метод контроля (с помощью химических индикаторов) должен использоваться совместно с физическим (с применением контрольно-измерительных и регистрирующих приборов) и биологическим (с применением биологических индикаторов). Ни один из трех методов контроля не может рассматриваться в качестве главного или второстепенного. Если хотя бы один метод контроля показал неудовлетворительный результат, то проведенный цикл стерилизации считается неудовлетворительным даже при удовлетворительном результате контроля другими методами.
ПРИМЕЧАНИЕ — физическим и химическим методами необходимо контролировать каждый цикл стерилизации, периодичность биологического контроля регламентируется специальными нормативными документами. В промежутке между периодическими проверками с помощью биологических индикаторов контроль осуществляется только физическим и химическим методами.
3.4. Ни один из трех методов контроля не может служить доказательством стерильности обработанных изделий, поскольку:
а) все три метода контроля являются косвенными, так как не являются средством обнаружения выживших микроорганизмов естественного обсеменения в/на стерилизованном изделии;
б) средства контроля невозможно разместить во всех точках предполагаемого нахождения инактивируемых микроорганизмов в/на стерилизованном изделии;
в) все три метода предназначены для подтверждения соблюдения заранее определенных условий (физических параметров), необходимых для надежной стерилизации.
3.5. Критическими параметрами, существенными для достижения надежной стерилизации и требующими контроля, являются:
— для воздушной стерилизации — температура стерилизации и время стерилизационной выдержки;
— для паровой стерилизации — температура стерилизации, время стерилизационной выдержки и наличие насыщенного водяного пара.
3.6. Важнейшими характеристиками химических индикаторов являются контрольные значения — значения одного или нескольких критических параметров, при которых химический индикатор достигает своего конечного состояния. Для индикаторов, изменяющих при стерилизации свой цвет, конечным состоянием является конечный цвет индикатора. По контрольным значениям индикатора определяют, подходит ли он для контроля в конкретном цикле стерилизации. Согласно ГОСТ Р ИСО 11140-1, контрольные значения обязательно должны быть приведены в маркировке или инструкции по применению индикаторов.
3.7. Целью текущего и периодического контроля является подтверждение соблюдения всех критических параметров стерилизации. Для этой цели применимы химические индикаторы 4-6 классов по ГОСТ Р ИСО 11140-1, реагирующие на все критические параметры. Применение средств контроля только одного параметра (например, максимальных термометров или химических однопараметрических индикаторов плавления 3 класса) может привести к ошибочным результатам, вводящим в заблуждение. Применение для контроля параметров стерилизации индикаторов 1 класса («свидетелей») недопустимо, поскольку они не позволяют судить о соблюдении параметров стерилизации, а предназначены только для того, чтобы визуально отличить упаковки, прошедшие стерилизацию, от нестерилизованных в тех случаях, когда существует риск смешения потоков стерилизованных и нестерилизованных изделий.
3.8. В нормативных документах (ГОСТ 19569*, ГОСТ 22649, МУ 287-113) под режимом стерилизации понимается совокупность физических параметров, поддерживаемых на стадии стерилизационной выдержки в камере стерилизатора, т.е. вне стерилизуемых изделий. Но физические параметры (например, температура) в камере стерилизатора и внутри стерилизуемого изделия не могут быть одинаковыми в течение всего времени стерилизационной выдержки. Часть этого времени (время выравнивания) тратится на то, чтобы стерилизующий агент проник в изделие и обеспечил внутри него условия, необходимые для надежной стерилизации.
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 51935-2002. — Примечание изготовителя базы данных.
При воздушной стерилизации в течение времени выравнивания происходит прогрев упаковки и содержащихся в ней воздуха и изделия до температуры стерилизации. Время выравнивания при воздушной стерилизации сильно зависит от:
— наличия и вида упаковки. Стерилизуемые в открытом виде неупакованные изделия прогреваются очень быстро, а любая, даже самая простая упаковка (например, бумажная или полиамидная) оказывает сопротивление теплопередаче. Еще большее сопротивление проникновению тепла оказывает многослойная упаковка или металлические контейнеры большого объема. Возможность применения упаковки конкретного вида определяется при разработке режима стерилизации и/или на стадии валидации процесса стерилизации;
— геометрии, материала и массы стерилизуемого изделия. Изделия с внутренними полостями, особенно из неметаллических теплоизолирующих материалов, изделия больших размеров, образующие объемные упаковки, и массивные изделия прогреваются медленнее легких изделий простой формы из теплопроводящих металлов;
— соблюдения правил загрузки стерилизатора. Перегрузка камеры и перекрывание каналов циркуляции воздуха могут привести к резкому увеличению времени выравнивания вплоть до недостижения температуры стерилизации в/на изделиях.
При паровой стерилизации в течение времени выравнивания происходит проникновение пара внутрь пористых изделий или изделий с внутренними полостями, а также удаление остаточного воздуха, находящегося в толще пористых изделий или в полостях, каналах или капиллярах изделий с внутренними полостями (в «воздушных карманах»), который не был удален на предварительной стадии удаления воздуха. Время выравнивания при паровой стерилизации зависит от:
— способа удаления воздуха из камеры и изделий перед стерилизационной выдержкой. Продувка камеры паром является не очень эффективным способом, она не обеспечивает полное удаление воздуха из пор и внутренних каналов изделий. Окончательное удаление воздуха из «воздушных карманов» происходит в процессе его медленного замещения паром уже на стадии стерилизационной выдержки, на что может потребоваться до 10-20 мин (время выравнивания). По этой причине в стерилизаторах с продувкой паром необходимы «длинные» режимы стерилизации (120 ±2 °С — 45 мин и 132±2 °С — 20 мин).
Напротив, многократное вакуумирование с помощью вакуумного насоса или высокоэффективного эжектора является очень надежным способом удаления воздуха. При его применении практически весь воздух удаляется даже из самых труднодоступных мест изделий еще до начала стерилизационной выдержки, а очень короткое время выравнивания (15-30 сек) обусловлено быстро протекающим процессом выравнивания давления внутри изделий с давлением в камере. По этой причине в стерилизаторах с многократным вакуумированием оказывается возможным применение «коротких» режимов стерилизации, не предусматривающих продолжительного времени выравнивания (121±1 °С — 20 мин, 126±1 °С — 10 мин и 134±1 °С — 5 мин).
— соблюдения правил упаковки изделий и загрузки стерилизатора. Нарушение правил, особенно в стерилизаторах с продувкой паром, приводит к значительному увеличению времени выравнивания вплоть до неудовлетворительной стерилизации.
3.9. Для правильного понимания методики контроля стерилизации введены понятия трудно стерилизуемое изделие и трудно стерилизуемое место изделия.
Трудно стерилизуемое изделие — это изделие, представляющее повышенное сопротивление проникновению стерилизующего агента/агентов. Общепринятыми примерами трудно стерилизуемых изделий являются:
— при паровой стерилизации — пористые изделия из паропроницаемых хлопчатобумажных и синтетических тканых или нетканых материалов (простыни, вата, бинты и т.п.) и изделия из паронепроницаемых материалов с внутренними полостями или каналами (резиновые перчатки, катетеры, зонды, склянки с ватными пробками и т.п.);
— при воздушной стерилизации — изделия из теплоизолирующих материалов с внутренними полостями (склянки, закрытые чашки Петри и др.).
Для всех методов стерилизации упаковка является фактором, увеличивающим сопротивление проникновению стерилизующего агента внутрь изделия. Степень сопротивления зависит от конструкции (сложности) и материала упаковки и должна учитываться при проведении текущего контроля стерилизации.
Трудно стерилизуемое место изделия — это место внутри изделия, наиболее трудно доступное для проникновения стерилизующего агента/агентов. Примерами трудно стерилизуемых точек изделия являются внутренние полости пальцев резиновой перчатки, средняя часть канала или капилляра катетера, зонда, середина хлопчатобумажного свертка, внутренняя полость закрытой чашки Петри, пробирки с ватной пробкой и т.п.
3.10. Из сказанного выше в 3.7 и 3.8 следует, что для эффективного контроля стерилизации химическими индикаторами требуется:
— контролировать условия в камере стерилизатора (снаружи стерилизуемых упаковок). «Наружные» индикаторы для этой цели прикрепляют с внешней стороны стерилизуемых упаковок. Индикатор доступен для получения результата контроля и документирования в месте проведения стерилизации сразу после ее завершения;
— контролировать условия внутри стерилизуемых изделий и упаковок. «Внутренние» индикаторы для этой цели размещают в трудно стерилизуемом месте изделия/упаковки. Индикатор доступен для получения результата контроля и документирования только в месте вскрытия упаковки со стерильной продукцией после извлечения индикатора из трудно стерилизуемого места.
3.11. Целью применения индикаторов 1 класса является получение визуального отличия стерилизационных упаковок/коробок с изделиями, подвергнутых стерилизационной обработке конкретным методом, от не подвергавшихся такой обработке. Применение данных индикаторов направлено на предотвращение смешения обработанных и необработанных стерилизационных упаковок/коробок.
3.12. Целью применения индикаторов 4 и 5 классов является контроль условий стерилизации — подтверждение того, что при проведении цикла стерилизации критические параметры достигли определенных значений, требующихся для обеспечения стерилизации изделий соответствующим методом.
3.13. Изменение цвета индикаторной метки на конечный цвет (соответствие цвету эталона сравнения) интерпретируется как положительный результат и является основанием для разрешения применения стерилизованных изделий по назначению.
3.14. Если индикаторная метка не достигла конечного цвета (не соответствует цвету эталона), это интерпретируется как отрицательный результат.
Если отрицательный результат показал «наружный» индикатор, то нестерильной считается вся загрузка проведенного цикла.
Если отрицательный результат показал «внутренний» индикатор, то нестерильными считаются изделия внутри данной упаковки.
Изделия, отнесенные к нестерильным, запрещается использовать по назначению; они подлежат повторной стерилизации.
3.15. Применение индикаторов 4-5 класса позволяет обнаружить несоблюдение условий стерилизации, обусловленное технической неисправностью стерилизаторов, нарушением правил их загрузки и упаковывания изделий, ошибкой в установке параметров режимов или их сбоем, и тем самым уменьшить риск использования изделий, подвергнутых стерилизационной обработке при значениях критических параметров, не соответствующих требуемым для конкретного метода и режима стерилизации.
3.16. «Наружные» индикаторы подлежат осмотру непосредственно после завершения цикла стерилизации с последующим подклеиванием в журнал контроля работы стерилизаторов.
«Внутренние» индикаторы подлежат осмотру после вскрытия стерилизационной упаковки/стерилизационной коробки перед применением стерилизованных изделий. Эти индикаторы подклеивают, например, в операционный или процедурный журнал. Допускается (при децентрализованной стерилизации) их подклеивание в журнал контроля работы стерилизаторов.
4. ИНДИКАТОРЫ ПАРОВОЙ СТЕРИЛИЗАЦИИ
4.1. Основные характеристики индикаторов паровой стерилизации медицинских изделий приведены в таблице 1.
Таблица 1 — Характеристика индикаторов паровой стерилизации производства НПФ «ВИНАР»
|
Цвет индикаторной метки |
||||||||
|
Обозначение индикатора |
Вид индикатора |
Назначение индикатора |
Класс инди- |
Контро- |
Метод удаления воздуха из стерилиза- |
исходный |
конечный — цвет эталона сравнения |
Наличие и размещение эталона сравнения |
|
8 |
||||||||
|
ИСПС-01 |
Этикетка с липким слоем (в листах и рулонах) |
Индикатор- |
Все режимы паровой стерилизации |
Продувка паром или вакууми- |
Желтый |
Коричневый |
Эталон отсутствует, конечный цвет обозначен словами |
|
|
ИСПС-02 |
Этикетка с липким слоем и дополнительными надписями (в листах и рулонах) |
|||||||
|
ИС-120 |
Бумажная лента без липкого слоя (в рулоне) |
Наружный контроль |
120 °С, 45 мин |
Продувка паром |
От белого до светло- |
От светло- |
Входит в виде отдельного элемента в комплект к каждому рулону ленты |
|
|
ИС-132 |
132 °С, 20 мин |
|||||||
|
МедИС-120/45 |
Полоска без липкого слоя |
Наружный контроль |
120 °С, 45 мин |
Продувка паром |
Зеленый |
Коричневый |
Нанесен на индикатор |
|
|
МедИС-120/45-01 |
Полоска с липким слоем |
|||||||
|
МедИС-126/30 |
Полоска без липкого слоя |
126 °С, 30 мин |
||||||
|
МедИС-126/30-01 |
Полоска с липким слоем |
|||||||
|
МедИС-132/20 |
Полоска без липкого слоя |
132 °С, 20 мин |
||||||
|
МедИС-132/20-01 |
Полоска с липким слоем |
|||||||
|
СТЕРИКОНТ- |
Полоска без липкого слоя |
Наружный контроль |
120 °С, 45 мин |
Продувка паром |
Желтый |
Сине- |
Нанесен на индикатор |
|
|
СТЕРИКОНТ- |
Полоска с липким слоем |
|||||||
|
СТЕРИКОНТ- |
Полоска без липкого слоя |
132 °С, 20 мин |
||||||
|
СТЕРИКОНТ- |
Полоска с липким слоем |
|||||||
|
СТЕРИТЕСТ- |
Полоска без липкого слоя |
Внутренний контроль |
120 °С, 45 мин |
Продувка паром |
Красно- |
Темный сине- |
Нанесен на индикатор |
|
|
СТЕРИТЕСТ- |
Полоска с липким слоем |
|||||||
|
СТЕРИТЕСТ- |
Полоска без липкого слоя |
132 °С, 20 мин |
||||||
|
СТЕРИТЕСТ- |
Полоска с липким слоем |
|||||||
|
ИНТЕСТ- |
Полоска без липкого слоя |
Наружный и внутренний контроль |
121 °С, 20 мин |
Вакууми- |
Красно- |
Темный сине- |
Нанесен на индикатор |
|
|
ИНТЕСТ- |
Полоска с липким слоем |
|||||||
Контроль стерилизации
Основные противоэпидемические мероприятия
для предотвращения возникновения ВБИ
Стерилизация – удаление или уничтожение всех живых микроорганизмов (вегетативных и споровых форм) внутри или на поверхности предметов. Стерилизация проводится различными методами: физическими, механическими и химическими.
Методы стерилизации
Физические методы. При стерилизации физическими методами используют действие высоких температур, давления, ультрафиолетового облучения и др.
Самым распространенным методом стерилизации является воздействие высокой температуры. При температуре, приближающейся к 1000С, происходит гибель большинства патогенных бактерий и вирусов. Споры почвенных бактерий-термофилов погибают при кипячении в течение 8,5 часов. Наиболее простой, но надежный вид стерилизации – прокаливание. Его применяют при поверхностной стерилизации негорючих и теплоустойчивых предметов непосредственно перед их использованием.
Другим простым и легко доступным методом стерилизации считается кипячение. Этот процесс проводят в стерилизаторе – металлической коробке прямоугольной формы с двумя ручками и плотно закрывающейся крышкой. Внутри расположена вынимающаяся металлическая сетка с ручками по бокам, на которую кладут стерилизуемый инструмент. Основной недостаток метода заключается в том, что он не уничтожает споры, а только вегетативные формы.
При паровой стерилизации необходимо выполнение определенных условий, которые гарантируют ее эффективность и сохранение стерильности изделий в течение определенного срока. Прежде всего, стерилизация инструментов, операционного белья, перевязочного материала должна проводиться в упаковке. С этой целью используют: стерилизационные коробки (биксы), двойную мягкую упаковку из бязи, пергамент, влагопрочную бумагу (крафт-бумага), полиэтилен высокой плотности.
Обязательное требование к упаковке – герметичность. Сроки сохранения стерильности зависят от вида упаковки и составляют трое суток для изделий простерилизованных в коробках без фильтров, в двойной мягкой упаковке из бязи, бумаги мешочной влагопрочной.
Стерилизация сухим жаром. Процесс стерилизации сухим жаром проводят в сухожаровом шкафу (в печи Пастера и др.) – металлическом шкафу с двойными стенками. В корпусе шкафа расположены рабочая камера, в которой имеются полки для размещения предметов для обработки и нагревательные элементы, которые служат для равномерного нагрева воздуха в рабочей камере
Режимы стерилизации:
— температура 1500С – 2 часа;
— температура 1600С -1700C – 45 минут-1час;
— температура 1800C – 30 минут;
— температура 2000C – 10-15 минут.
Необходимо помнить, что при температуре 1600С бумага и вата желтеют, при более высокой температуре – сгорают (обугливаются). Началом стерилизации является тот момент, когда температура в печи достигает нужной величины. После окончания стерилизации печь выключается, прибор остывает до 500С, после чего из него вынимают простерилизованные предметы.
Стерилизация текучим паром. Этот вид стерилизации производится в аппарате Коха или в автоклаве при незавинченной крышке и открытом выпускном кране. Аппарат Коха представляет собой металлический полый цилиндр с двойным дном. Стерилизуемый материал загружают в камеру аппарата не плотно, для того, что бы обеспечить возможность наибольшего контакта его с паром. Начальный подогрев воды в приборе происходит в течение 10-15 минут. Текучим паром стерилизуют материалы, которые разлагаются или портятся при температуре выше 1000С – питательные среды с углеводами, витаминами, растворы углеводов и т. п.
Стерилизацию текучим паром проводят дробным методом – при температуре не выше 1000С по 20-30 минут в течение 3-х дней. При этом вегетативные формы бактерий погибают, а споры сохраняют жизнеспособность и прорастают в течение суток при комнатной температуре. Последующее прогревание обеспечивает гибель этих вегетативных клеток, появляющихся из спор в промежутках между этапами стерилизации.
Тиндализация – метод дробной стерилизации, при котором прогревание стерилизуемого материала проводится при температуре 56-580С в течение часа 5-6 дней подряд.
Пастеризация – однократное нагревание материала до 50-650С (в течение 15-30 минут), 70-800С (в течение 5-10 минут). Используется для уничтожения бесспоровых форм микробов в пищевых продуктах (молоко, соки, вино, пиво).
Стерилизация паром под давлением. Стерилизация проводится в автоклаве под давлением обычно (посуда, физиологический раствор, дистиллированная вода, питательные среды, не содержащие белков и углеводов, различные приборы, изделия из резины) в течение 20-30 минут при температуре 120-1210С (1 атм.), хотя могут быть использованы и другие соотношения между временем и температурой в зависимости от стерилизуемого объекта.
Любые растворы, содержащие белки и углеводы, стерилизуют в автоклаве при 0,5 атм. (1150С) в течение 20-30 минут
Любой инфицированный микроорганизмами (заразный) материал стерилизуют при давлении в 1,5 атм. (1270С) – 1 час, или при давлении 2,0 атм. (1320С) – 30 минут.
Стерилизация облучением. Излучение может быть неионизирующим (ультрафиолетовое, инфракрасное, ультразвуковое, радиочастотное) и ионизирующим – корпускулярным (электроны) или электромагнитным (рентгеновские лучи или гамма-лучи).
Ультрафиолетовое облучение (254 нм) обладает малой проникающей способностью, поэтому требует достаточно длительного воздействия и используется в основном для стерилизации воздуха, открытых поверхностей в помещениях.
Ионизирующее излучение, в первую очередь, гамма-облучение успешно применяется для стерилизации в промышленных условиях медицинских изделий из термолабильных материалов, поскольку позволяет быстро облучать материалы еще на стадии производства (при любой температуре и герметичной упаковке).Используется для получения стерильных одноразовых пластмассовых изделий (шприцы, системы для переливания крови, чашки Петри), и хирургических перевязочных и шовных материалов.
Механические методы. Фильтры задерживают микроорганизмы благодаря пористой структуре матрикса, но для пропускания раствора через фильтр требуется вакуум или давление, поскольку сила поверхностного натяжения при таком малом размере пор не дает жидкостям фильтроваться.
Существуют 2 основных типа фильтров – глубинные и фильтрующие. Глубинные фильтры состоят из волокнистых или гранулированных материалов (асбест, фарфор, глина), которые спрессованы, свиты или связаны в лабиринт проточных каналов, поэтому четкие параметры размера пор отсутствуют. Частицы задерживаются в них в результате адсорбции и механического захвата в матриксе фильтра, что обеспечивает достаточно большую емкость фильтров, но может приводить к задержке части раствора.
Фильтрующие фильтры имеют непрерывную структуру, и эффективность захвата ими частиц определяется в основном соответствию их размеру пор фильтра. Мембранные фильтры имеют низкую емкость, их эффективность не зависит от скорости протока и перепада давлений, а фильтрат почти или совсем не задерживается.
Мембранная фильтрация в настоящее время широко применяется для стерилизации масел, мазей и растворов, неустойчивых к нагреванию, – растворы для внутривенных инъекций, диагностические препараты, растворы витаминов и антибиотиков, среды для культур тканей и т.д.
Химические методы. Химические методы стерилизации, связанные с использованием химических веществ, обладающих явно выраженной антимикробной активностью, делятся на 2 группы: а) стерилизация газами; б) растворами (известна как дезинфекция).
Химические методы стерилизации газами применяют в лечебно-профилактических учреждениях для обеззараживания медицинских материалов и оборудования, которые нельзя стерилизовать другими способами (оптические приборы, кардиостимуляторы, аппараты искусственного кровообращения, эндоскопы, изделия из полимеров, стекла).
Бактерицидными свойствами обладают многие газы (формальдегид, окись пропилена, озон, надуксусная кислота и метилбромид), но шире всего используется окись этилена, поскольку она хорошо совместима с различными материалами (не вызывает коррозию металла, порчи обрабатываемых изделий из бумаги, резины и всех марок пластмасс). Время экспозиции при использовании газового метода стерилизации варьирует от 6 до 18 часов в зависимости от концентрации газовой смеси и объема специального аппарата (емкости) для этого вида стерилизации. Стерилизация растворами применяется при обработке больших поверхностей (пространств) или медицинских приборов, которые не могут быть обеззаражены другими методами.
Предстерилизационная обработка. Согласно требованиям отраслевого стандарта большинство изделий медицинского назначения из металла, стекла, пластмасс, резины проходят предстерилизационную обработку, состоящую из нескольких этапов:
— замачивание в моющем растворе при полном погружении изделия в дезинфицирующий раствор в течение 15 минут;
— мойка каждого изделия в разобранном виде в моющем растворе в ручном режиме в течение 1 минуты;
— ополаскивание под проточной водой хорошо промытых изделий в течение 3-10 минут;
— сушка горячим воздухом в сушильном шкафу.
Контроль качества предстерилизационной очистки изделий медицинского назначения на наличие крови проводят путем постановки амидопириновой пробы. Остаточные количества щелочных компонентов моющего средства определяют с помощью фенолфталеиновой пробы.
Согласно требованиям этого же ОСТа обязательным условием стерилизации растворами изделий медицинского назначения является полное погружение изделий в стерилизационный раствор в разобранном виде, с заполнением каналов и полостей, при температуре раствора не менее 18°С.
После стерилизации изделия быстро извлекают из раствора с помощью пинцетов или корнцангов, удаляют раствор из каналов и полостей, затем дважды последовательно промывают простерилизованные изделия стерильной водой.
Простерилизованные изделия используют сразу по назначению или помещают в стерильную емкость, выложенную стерильной простыней, и хранят не более 3-х суток. Препараты, используемые для стерилизации, классифицируют по группам: кислоты или щелочи, перекиси (6% раствор перекиси водорода), спирты (этиловый, изопропиловый), альдегиды (формальдегид, глутаровый альдегид), галогены (хлор, хлорамин, иодофоры – вескодин), четвертичные аммониевые основания, фенольные соединения (фенол, крезол), 20% Бианол, 20% Колд-Спор. Кроме того, в качестве удобных и экономичных дезинфицирующих растворов могут использоваться универсальные препараты, т.е. позволяющие проводить обеззараживание от всех форм микроорганизмов (бактерий, в том числе микобактерий туберкулеза; вирусов, включая ВИЧ; патогенных грибов), или комбинированные препараты («Дезэффект», «Аламинал», «Септодор», «Виркон»), совмещающие одновременно два процесса – дезинфекцию и предстерилизационную обработку.
Биологическая стерилизация основана на применении антибиотиков; используют ограниченно.
Контроль стерилизации осуществляется физическими, химическими и биологическими методами.
Физический метод контроля осуществляют с помощью средств измерений температуры (термометры) и давления (манометры).
Химический метод контроля предназначен для оперативного контроля одного или нескольких в совокупности режимов работы паровых и воздушных стерилизаторов. Осуществляют его с помощью химических тестов и термохимических индикаторов. Химические тесты – это запаянная с обоих концов стеклянная трубка, заполненная смесью химических соединений с органическими красителями, или только химическим соединением, изменяющим свое агрегатное состояние и цвет при достижении для него определенной температуры плавления. Упакованные химические тесты нумеруют и размещают в разных контрольных точках паровых и воздушных стерилизаторов. Термохимические индикаторы представляют собой полоски бумаги, на одной стороне которых нанесен индикаторный слой, изменяющий свой цвет на цвет эталона при соблюдении температурных параметров режима стерилизации.
Биологический метод предназначен для контроля эффективности работы стерилизаторов на основании гибели спор тест-культур. Осуществляют его с помощью биотестов. Биотест – дозированное количество тест-культуры на носителе, например, на диске из фильтровальной бумаги, или помещенное в упаковку (стеклянные флаконы для лекарственных средств или чашечки из фольги). В качестве тест-культуры для контроля работы парового стерилизатора используются споры Bacillus stearothermophilus ВКМ В-718, а воздушного стерилизатора – споры Bacillus licheniformis. После стерилизации тесты помещают на питательную среду. Отсутствие роста на питательной среде свидетельствует о гибели спор во время стерилизации.
Биологический контроль. Этот вид контроля проводят 2 раза в год. Для этого используют биотесты, предназначенные для конкретного вида паровой или суховоздушной стерилизации.
Пронумерованные пакеты с биотестами размещают в контрольных точках стерилизатора. После проведенной стерилизации в пробирки с биотестами вносят 0,5 мл цветной питательной среды, начиная со стерильной пробирки для контроля питательной среды и заканчивая контрольным тестом, не подвергавшимся стерилизации (контроль культур). Далее пробирки инкубируют. После чего проводят учет изменения цвета питательной среды. В контроле (стерильная проба) цвет среды не изменяется. В пробирке с контролем культуры цвет среды должен измениться на цвет указанный в паспорте, что свидетельствует о наличии жизнеспособных спор.
Работа считается удовлетворительной, если цвет питательной среды во всех биотестах не изменился. Результаты регистрируют в журнале.
При необходимости контроля за стерильностью медицинских изделий, подвергнутых стерилизации, лаборант бактериологической лаборатории или операционная сестра под руководством сотрудников баклаборатории осуществляет забор проб на стерильность.
Центральное стерилизационное отделение в лпу (цсо).
Задача центрального стерилизационного отделения (ЦСО) состоит в обеспечении лечебно-профилактических учреждений стерильными изделиями медицинского назначения: хирургическими инструментами, шприцами, иглами, контейнерами, хирургическими перчатками, лейкопластырями, перевязочными и шовными материалами и др.
Функции центрального стерилизационного отделения (ЦСО):
-прием, хранение различных материалов до их обработки и стерилизации;
— разборка, выбраковка, учет изделий;
— предстерилизационная очистка (мытье, сушка);
— комплектование, упаковка, укладка в стерилизационную тару;
— стерилизация изделий;
— контроль качества предстерилизационной очистки и стерилизации;
— ведение документации и строгий учет приема и выдачи изделий;
— выдача стерильных изделий больницам, поликлиникам.
Помещения любого центрального стерилизационного отделения (ЦСО) обычно подразделяются на 2 зоны: нестерильную и стерильную. Структура ЦСО предусматривает последовательное прохождение обрабатываемыми изделиями ряда этапов, начиная от приема и сортировки, стерилизации, хранения простерилизованных изделий, и выдачи их для проведения соответствующих манипуляций.
В нестерильной зоне располагаются: моечная, комната изготовления, укладки и упаковки перевязочных материалов, комната обработки перчаток, стерилизационная (загрузочная сторона стерилизатора, нестерильная половина), комната контроля, комплектации и упаковки инструментов, кладовая упаковочных материалов, кабинет персонала, санитарный узел.
В стерильной зоне располагаются: стерилизационная (разгрузочная сторона стерилизатора, если они шкафного типа), склад для стерильных инструментов, экспедиция.
Уборку производственных помещений ЦСО проводят 1 раз в день с обязательным применением дезинфицирующих средств. В ЦСО должна быть обязательно оборудована приточно-вытяжная вентиляция. Полы в этом отделении должны быть покрыты гидроизоляцией, обложены плиткой или покрыты линолеумом. Потолки покрашены масляной краской.
При планировании работы ЦСО необходимо предусматривать организацию 2-х поточной обработки:
1 поток – обработка и стерилизация инструментов, шприцов, игл, резиновых изделий;
2 поток – подготовка и стерилизация белья и перевязочного материала.
Контроль санитарно-гигиенического состояния ЦСО проводится прежде всего микробиологическими методами. При проведении контроля исследуют воздух в ЦСО, делают смывы с предметов медицинского назначения и оборудования, проверяют качество стерилизации.
Основным критерием удовлетворительного санитарного состояния ЦСО является:
— в нестерильной зоне до начала работы в 1 м3 общее микробное число (ОМЧ) должно быть не более 750, во время работы ОМЧ не должно превышать 1500;
— в стерильной зоне до начала работы в 1 м3 ОМЧ должно быть не более 500, во время работы ОМЧ не должно превышать 750.
Стерилизация, определение, методы, контроль качества
Стерилизация — это процесс уничтожения всех видов микробной флоры, в том числе их споровых форм, и вирусов с помощью физических или химических воздействий. Принято считать медицинское изделие стерильным, если вероятность его бионагрузки равна или менее 10 в степени -6. Стерилизации должны подвергаться медицинские изделия, контактирующие с кровью пациента, контактирующие с раневой поверхностью и соприкасающиеся со слизистой оболочкой и могущие вызвать нарушение ее целостности. Стерилизация -сложный процесс, для успешной реализации которого необходимы следующие требования:
— эффективная очистка;
— соответствующие упаковочные материалы;
— соблюдение правил упаковки медицинских изделий;
— соблюдение правил по загрузке стерилизатора упаковками с медицинскими изделиями;
— адекватное качество и количество стерилизуемого материала; соответствующая работа оборудования;
— соблюдение правил хранения, обращения и транспортировки простерилизованного материала.
Процесс стерилизации медицинских инструментов и изделий от момента окончания операции и до стерильного хранения или следующего применения включает в себя выполнение мероприятий в определенной последовательности. Все этапы должны быть строго соблюдены для обеспечения стерильности и длительного срока жизни инструментов. Схематично это можно представить следующим образом:
Отложить инструменты после использования Дезинфекция -> Механическая очистка инструмента -> Проверить на повреждения -> Промыть инструменты Сушка -> Упаковать в стерилизационную упаковку -> Стерилизация -> Стерильное хранение/применение. При применении стерилизационной упаковки (бумага, фольга или стерилизационные контейнеры) инструменты могут храниться в стерильном виде и позднее использоваться от 24 часов до 6 месяцев.
В лечебно-профилактических учреждениях применяется несколько форм организации стерилизации: децентрализованная, централизованная, осуществляемая в ЦСО, и смешанная. В амбулаторной стоматологической практике чаще применяется децентрализованная стерилизация (особенно в частных клиниках). Централизованная стерилизация характерна для районных стоматологических поликлиник и больших частных клиник. Децентрализованная стерилизация имеет ряд существенных недостатков, влияющих на ее эффективность. Предстерилизационная обработка изделий выполняется чаще всего вручную и при этом качество очистки изделий оказывается низким. Контроль за соблюдением технологии проведения стерилизации, правил упаковки, загрузки изделий в стерилизаторы и за эффективностью работы оборудования в условиях децентрализованной стерилизации затруднен. Все это приводит к снижению качества стерилизации. При применении централизованной формы стерилизации удается достичь более высоких результатов стерилизации за счет совершенствования существующих и внедрению новейших методов стерилизации (механизация мойки инструментов и медицинских изделий, облегчение работы среднего медицинского персонала и др.). В централизованном стерилизационном отделении выделяют: моечную, дезинфекционную, упаковочную и подразделение для стерилизации и раздельного хранения стерильных предметов. Температура воздуха во всех подразделениях должна быть от 18°С до 22°С, относительная влажность — 35-70%, направление потока воздуха — от чистых к относительно загрязненным зонам.
Методы стерилизации
Стерилизация осуществляется физическими методами: паровая, воздушная, гласперленовая (в среде нагретых стеклянных шариков), радиационная, с применением инфракрасного излучения, и химическими методами: растворы химических средств и газы (табл. 3). В последние годы применяется озоновая (стерилизатор С0-01-СПБ) и плазменная стерилизация (установка «Стеррад»), используются установки на основе окиси этилена, паров формальдегида. Выбор метода стерилизации изделий зависит от их устойчивости к методам стерилизационного воздействия.
Преимущества и недостатки различных методов стерилизации представлены в таблице.

Таблица. Преимущества и недостатки различных методов стерилизации
Контроль качества стерилизации является одним из наиболее важных мероприятий. Физический метод контроля работы стерилизаторов заключается в измерении таких параметров, как температура, давление и время стерилизации. Любое отклонение от стандартных режимов стерилизации является сигналом для оператора о вероятном сбое аппаратуры. Химический метод контроля заключается в регистрации изменения цвета или физических свойств индикаторов, использующихся для контроля времени экспозиции и условий стерилизации. Наиболее важным методом контроля качества стерилизации является биологический метод. Центры по контролю и профилактике заболеваний рекомендуют проводить контроль работы паровых стерилизаторов в стационарах как минимум 1 раз в неделю. В качестве биологических индикаторов в воздушных стерилизаторах используются споры Bacillus stearothermophilus, в газовых стерилизаторах — споры Bacillus subtilus (биовары niger или globigii). Споровый биологический контроль необходимо проводить при каждой загрузке стерилизатора «критическими» предметами. Критические инструменты и сосудистые катетеры не должны использоваться до получения отрицательного результата спорового теста. В идеале зона хранения стерильных предметов должна находиться рядом со стерилизационной, при этом стерильные изделия должны быть защищены от пыли, влаги, насекомых, паразитов, перепадов температуры и влажности. Стерильные изделия должны быть разложены таким образом, чтобы защитить упаковку от повреждений, изломов, сдавления и проколов. «Сроком годности» называется время, в течение которого изделия сохраняют стерильность. По различным данным, срок годности измеряется от 2 дней до неопределенного времени, однако в большинстве исследований не учитывался тип упаковочного материала и условия хранения. Потеря стерильности зависит от условий хранения и практически не зависит от времени. Для транспортировки стерильных инструментов в операционную и другие отделения стационара необходимо обеспечить дополнительное покрытие, защищающее от пыли, которое можно легко удалить перед входом в чистую зону.
Все изделия перед стерилизацией подвергаются предстерилизационной очистке.
При стерилизации физическими методами (паровым, воздушным) изделия, как правило, стерилизуют упакованными в упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению в России. При паровом методе могут применяться стерилизационные коробки без фильтров и с фильтром. При воздушном методе, а также при паровом и газовом методах допускается стерилизация инструментов в неупакованном виде.
Паровой метод стерилизации
Паровым методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла, хирургическое белье, перевязочный и шовный материал, изделия из резины (катетеры, зонды, трубки), из латекса, пластмасс. При паровом методе стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/см2) — 0,21 МПа (2,1 кгс/см2) (1,1-2,0 бар) температурой 110-134°С. Процесс стерилизации происходит в стерилизаторах (автоклавах). Полный цикл составляет от 5 до 180 минут (табл.). Согласно ГОСТ 17726-81, название данного класса устройств: «Стерилизатор паровой». Несмотря на то, что обработка паром достаточно эффективна, она не всегда может обеспечить стерилизацию инструмента. Причина этого состоит в том, что воздушные полости в стерилизуемых объектах могут послужить тепловым изолятором, как например, стоматологические турбинные наконечники. Для решения этой проблемы в автоклавах используется функция создания предварительного вакуума в импульсном режиме. Преимущества метода — короткий цикл, возможность стерилизации нетермостойких изделий, применение различных типов упаковки. Недостатком является высокая стоимость оборудования.

Таблица. Режимы и контроль паровой стерилизации
Воздушный метод стерилизации
Стерилизация при воздушном методе осуществляется сухим горячим воздухом температурой 160°, 180° и 200°С (табл.).
Таблица. Режимы и контроль стерилизации сухим горячим воздухом
Воздушным методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла с пометкой 200°С, изделия из силиконовой резины. Перед стерилизацией воздушным методом изделия подвергаются предстерилизационной очистке и обязательно высушиваются в сушильном шкафу при температуре 85°С до исчезновения видимой влаги. Полный цикл составляет до 150 минут. Преимущество стерилизации горячим воздухом по сравнению с паровым методом состоит в низкой себестоимости оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее 30 мин), опасность повреждения инструментов высокими температурами, невозможность стерилизации тканей и пластмасс, только один контрольный параметр — температура, высокие энергозатраты.
Гласперленовая стерилизация
Гласперленовая стерилизация осуществляется в стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков при рабочей температуре 190-330°С. При стерилизации сухие инструменты помещают в среду раскаленных стеклянных гранул на глубину более 15 мм. Этим методом могут быть простерилизованы только инструменты, размер которых не превышает 52 мм, они должны быть целиком погружены в камеру на 20-180 с в зависимости от размера. После стерилизации изделия используются сразу по назначению. Высокая рабочая температура и невозможность полного погружения инструментов в стерилизующую среду ограничивают возможность стерилизации широкого ассортимента медицинских изделий.
Стерилизация газовым методом
Для газового метода стерилизации применяют смесь окиси этилена и бромистого метила в весовом соотношении 1 : 2,5 соответственно (ОБ), окись этилена, пары раствора формальдегида в этиловом спирте, озон. Стерилизацию смесью ОБ и окисью этилена осуществляют при температуре не менее 18°С, 35°С и 55°С, парами раствора формальдегида в этиловом спирте при температуре 80°С. Перед газовой стерилизацией изделия после предстерилизационной очистки подсушивают до исчезновения видимой влаги. Удаление влаги из полостей изделий производят с использованием централизованного вакуума, а при его отсутствии с помощью водоструйного насоса, подсоединенного к водопроводному крану. При стерилизации ОБ и окисью этилена удаляют воздух до давления 0,9 кгс/см2. При использовании портативного аппарата после окончания стерилизации его выдерживают в вытяжном шкафу на протяжении 5 часов.
Озоном, вырабатываемым в озоновом стерилизаторе С0-01 -СПБ, стерилизуют изделия простой конфигурации из коррозионностойких сталей и сплавов, в неупакованном виде при температуре не более 40°С. Цикл стерилизации (выход на режим, стерилизация, дезактивация) составляет 90 минут. После стерилизации инструменты используют по назначению сразу без дополнительного проветривания. Срок сохранения стерильности изделий 6 часов, при соблюдении правил асептики. При упаковке в стерильную двухслойную х/б ткань срок стерильности составляет 3 суток, а при содержании в камере с бактерицидными облучателями — 7 суток.
В России имеет регистрацию единственная установка — стерилизатор газовый компании «Мюнхенер Медицин Механик ГмбХ» с использованием паров формальдегида, рекомендованный для стерилизации проблемной техники.
Инфракрасное воздействие
Новые методы стерилизации нашли свое отражение в стерилизаторе инфракрасной стерилизации, предназначенном для стерилизационной обработки металлических медицинских инструментов в стоматологии, микрохирургии, офтальмологии и других областях медицины.
Высокая эффективность ИК-стерилизующего воздействия обеспечивает полное уничтожение всех исследованных микроорганизмов, в том числе таких как: S. epidermidis, S. aureus, S. sarina flava, Citrobacter diversus, Str. pneumonia, Bacillus cereus.
Быстрый, в течение 30 секунд, выход на режим 200±3°С, короткий цикл стерилизационной обработки — от 1 до 10 минут, в зависимости от выбранного режима, наряду с низкой энергоемкостью, несравнимы по эффективности ни с одним из применяемых до настоящего времени методов стерилизации. Стерилизатор ИК-стерилизации прост в эксплуатации, не требует специально обученных операторов, а сам метод относится к экологически чистым технологиям. В отличие от паровой, воздушной или гласперленовой стерилизации, при ИК-стерилизации отсутствует агрессивное воздействие стерилизующего агента (инфракрасного излучения) на режущий инструмент.
Ионизирующее излучение
Активно действующими агентами являются гамма-лучи. В ЛПУ ионизирующее излучение не используется для дезинфекции. Его используют для стерилизации изделий однократного применения при производстве в заводских условиях.
Стерилизация растворами химических средств
Данный метод применяют для стерилизации изделий, материалы которых не являются термоустойчивыми, и применение других официально рекомендуемых методов невозможно. Недостатком данного метода является то, что изделия нельзя стерилизовать в упаковке и по окончании стерилизации их необходимо промыть стерильной жидкостью (водой или 0,9% раствором натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению микроорганизмами простерилизованных изделий. Для химических средств применяют стерильные емкости из стекла, термостойких пластмасс, выдерживающих стерилизацию паровым методом, металлов, покрытых эмалью. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна быть не менее 20°С для альдегидсодержащих средств и не менее 18°С для остальных средств (табл.).
Таблица. Стерилизация растворами химических средств
Химический метод стерилизации достаточно широко применяется для обработки «проблемной техники», например, для аппаратуры с волоконной оптикой, наркозной аппаратуры, кардиостимуляторов, стоматологического инструментария. Используются такие современные стерилизующие агенты, как глутаровый альдегид, производные ортофталевой и янтарной кислот, кислородосодержащие соединения и производные надуксусной кислоты в режиме экспресс-стерилизации и «Классической стерилизации». Перспективными считаются препараты, полученные на их основе — «Эригид форте», «Лизоформин-3000», «Сайдекс», «НУ Сайдекс», «Сайдекс ОПА», «Гигасепт», «Стераниос», «Секусепт актив», «Секусепт пульвер», «Аниоксид 1000», «Клиндезин форте», «Клиндезин окси», причем подводя экономическое обоснование использования этих препаратов, следует сделать вывод об их неравнозначности, которая определяется сроками использования рабочих растворов (например, из всех препаратов только «Эригид форте» имеет возможность использования рабочего раствора в течение 30 дней для «классической» стерилизации).
Разъемные изделия стерилизуют в разобранном виде. Во избежание нарушения концентрации стерилизационных растворов, погружаемые в них изделия должны быть сухими. Цикл обработки составляет 240-300 минут, что является существенным недостатком метода. Кроме того, недостатком является высокая стоимость дезинфектантов. Преимущество — нет специального оборудования. Промытые стерильные изделия после удаления жидкости из каналов и полостей используют сразу по назначению или после упаковки в двухслойную стерильную х/б бязь, помещают в стерильную коробку, выложенную стерильной простыней, на срок не более 3 суток.
Все работы по стерилизации изделий проводятся в асептических условиях в специальных помещениях, подготавливаемых как операционный блок (квар-цевание, генеральная уборка). Персонал использует стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3 сменах стерильной воды, по 5 минут в каждой.
Контроль эффективности стерилизации
Контроль эффективности стерилизации осуществляется физическими, химическими и бактериологическими методами.
К физическим методам контроля относятся: измерение температуры, давления и времени применения стерилизации.
Для проведения химического контроля на протяжении десятилетий применялись химические вещества, имеющие температуру плавления, близкую к температуре стерилизации. Такими веществами были: бензойная кислота — для паровой стерилизации; сахароза, гидрохинон и некоторые другие -для контроля воздушной стерилизации. Если происходило расплавление и изменение цвета указанных веществ, то результат стерилизации признавался удовлетворительным. Поскольку применение вышеуказанных индикаторов является недостаточно достоверным, в настоящее время внедрены в практику контроля термических методов стерилизации химические индикаторы, цвет которых изменяется под воздействием температуры, адекватной для конкретного режима, для определенного времени, необходимого для реализации данного режима. По изменению окраски индикаторов судят об основных параметрах стерилизации — температуре и продолжительности стерилизации. С 2002 года в России введен в действие ГОСТ РИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования», в котором химические индикаторы распределены на шесть классов:
К 1 классу отнесены индикаторы внешнего и внутреннего процесса, которые размещаются на наружной поверхности упаковки с медицинскими изделиями или внутри наборов инструментов и операционного белья. Изменение цвета индикатора указывает на то, что упаковка подверглась процессу стерилизации.
Ко 2 классу относят индикаторы, которые не контролируют параметры стерилизации, а предназначенные для применения в специальных тестах, например, на основании таких индикаторов оценивают эффективность работы вакуумного насоса и наличие воздуха в камере парового стерилизатора.
К 3 классу относятся индикаторы, при помощи которых определяется один параметр стерилизации, например, минимальная температура. Однако они не дают информации о времени воздействия температуры.
К 4 классу относят многопараметровые индикаторы, изменяющие цвет при воздействии нескольких параметров стерилизации. Примером таких индикаторов являются индикаторы паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест».
К 5 классу относят интегрирующие индикаторы, реагирующие на все критические параметры метода стерилизации.
К 6 классу относят индикаторы-эмуляторы. Индикаторы откалиброваны по параметрам режимов стерилизации, при которых они применяются. Эти индикаторы реагируют на все критические параметры метода стерилизации. Эмулирующие индикаторы являются наиболее современными. Они четко регистрируют качество стерилизации при правильном соотношении всех параметров — температуры, насыщенного пара, времени. При несоблюдении одного из критических параметров индикатр не срабатывает. Среди отечественных термовременных индикаторов используются индикаторы «ИС-120», «ИС-132», «ИС-160», «ИС-180» фирмы «Винар» или индикаторы паровой («ИКПС-120/45», «ИКПС-132/20») и воздушной («ИКПВС-180/60» и «ИКВС-160/150») стерилизации одноразового применения ИКВС фирмы «Медтест».
Основные правила использования индикаторов паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест»
Все операции с индикаторами — выемка, оценка результатов — осуществляются персоналом, проводящим стерилизацию.
Оценку и учет результатов контроля проводят, оценивая изменения цвета начального состояния термоиндикаторной метки каждого индикатора, сравнивая с цветовой меткой Эталона сравнения.
Если цвет конечного состояния термоиндикаторной метки всех индикаторов соответствует цветовой метке Эталона сравнения, это свидетельствует о соблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере.
Допускаются различия в интенсивности глубины окраски термоиндикаторной метки индикаторов, обусловленные неравномерностью допустимых значений температуры в различных зонах стерилизационной камеры. Если термоиндикаторная метка хотя бы одного индикатора полностью или частично сохранила цвет, легко отличимый от цвета эталонного состояния, это свидетельствует о несоблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере.
Индикаторы и Эталоны сравнения должны совпадать по номерам партий. Запрещается оценивать результаты контроля стерилизации, используя индикаторы разных партий.
Оценку соответствия изменения цвета термоиндикаторной метки в сравнении с Эталоном проводят при освещенности не менее 215 лк, что соответствует матовой лампе накаливания 40 Вт, с расстояния не более 25 см. Для проведения бактериологического контроля в настоящее время применяются биотесты, имеющие дозированное количество спор тест-культуры. Существующая методика позволяет оценивать эффективность стерилизации не ранее чем через 48 часов, что не позволяет применять уже простерилизованные изделия до получения результатов бактериологического контроля.
Биологический индикатор представляет собой препарат из патогенных споро-образующих микроорганизмов с известной высокой устойчивостью к данному типу стерилизационного процесса. Задачей биологических индикаторов является подтверждение способности стерилизационного процесса убивать устойчивые микробные споры. Это наиболее критичный и достоверный тест стерилизационного процесса. Применяются биологические индикаторы в качестве контроля загрузки: если результат положительный (микробный рост), то использовать данную загрузку нельзя и необходимо отозвать все предыдущие загрузки до последнего отрицательного результата. Для получения достоверного биологического ответа следует использовать только те биологические индикаторы, которые соответствуют международным стандартам ЕК 866 и ISO 11138/11135. При использовании биологических индикаторов возникают определенные трудности — необходимость наличия микробиологической лаборатории, обученного персонала, продолжительность инкубации многократно превышает длительность стерилизации, необходимость карантина (невозможность использования) простерилизованных изделий до получения результатов. Из-за указанных выше трудностей в применении биологического метода в амбулаторной стоматологической практике обычно используется физический и химический метод контроля эффективности стерилизации.
Источник: Особенности дезинфекции и стерилизации в амбулаторной стоматологии, Мороз Б.Т., Мироненко О.В. 2008г.