Содержание
- «Государственный реестр лекарственных средств. Том ii. Типовые клинико-фармакологические статьи» (по состоянию на 1 августа 2000 года) (лекарственные средства от А до Г)
- ОФС.1.4.2.0003.15 Извлекаемый объем лекарственных форм для парентерального применения
- Однодозовые лекарственные формы
- Многодозовые лекарственные формы
- Картриджи и заполненные шприцы
- Инфузионные растворы
- технология вопросы экзамен вопросы 33,34
- Стандартизация лекарственных средств. Фармакопейные статьи, их виды.
«Государственный реестр лекарственных средств. Том ii. Типовые клинико-фармакологические статьи» (по состоянию на 1 августа 2000 года) (лекарственные средства от А до Г)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННЫЙ РЕЕСТР ЛЕКАРСТВЕННЫХ СРЕДСТВ
ТОМ II
ТИПОВЫЕ КЛИНИКО — ФАРМАКОЛОГИЧЕСКИЕ СТАТЬИ
ОФИЦИАЛЬНОЕ ИЗДАНИЕ
(по состоянию на 1 августа 2000 г.)
СПИСОК СОКРАЩЕНИЙ
цГМФ циклический гуанозинмонофосфат
АДФ аденозиндифосфат
АМФ аденозинмонофосфат
АТФ аденозинтрифосфат
АКТГ адренокортикотропный гормон
АЧТВ активированное частичное тромбопластиновое время
АЛТ аланинаминотрансфераза
АПФ ангиотензинпревращающий фермент
АДГ антидиуретический гормон
АИК аппарат искусственного кровообращения
АД артериальное давление
ACT аспарагинаминотранфераза
AV атриовентрикулярный (-ая)
АСК ацетилсалициловая кислота
БМКК блокатор «медленных» кальциевых каналов
Вт ватт
ВИЧ вирус иммунодефицита человека
WPW Вольфа — Паркинсона — Уайта (синдром)
ВОЗ Всемирная организация здравоохранения
ГАМК гамма — аминомасляная кислота
ГЭБ гемато — энцефалический барьер
Hb гемоглобин
Гц герц
ГКС глюкокортикостероид
ДНК дезоксирибонуклеиновая кислота
ДМСО диметилсульфоксид
ДВС диссеминированное внутрисосудистое свертывание
др. другой(ие)
ЕД единицы действия
Fe железо
ЖКТ желудочно — кишечный тракт
Au золото
ИГСС идиопатический гипертрофический субаортальный стеноз
Ig иммуноглобулин
ИНД индивидуальная насыщающая доза
ИПП индивидуальная поддерживающая доза
ИВЛ искусственная вентиляция легких
ИБС ишемическая болезнь сердца
К калий
Ca кальций
кап капли
кв. м квадратный метр
кг килограмм
кДж килоджоуль
ккал килокалория
КОС кислотно — основное состояние
КЩС кислотно — щелочное равновесие
КК клиренс креатинина
Co кобальт
КФК креатинфосфокиназа
куб. м кубический метр
ЛДГ лактатдегидрогеназа
ЛПВП липопротеиды высокой плотности
ЛПНП липопротеиды низкой плотности
ЛПОНП липопротеиды очень низкой плотности
ЛГРГ лютеинизирующего гормона релизинг фактор
ЛГ лютеинизирующий гормон
Mg магний
Mn марганец
Cu медь
ME международные единицы
мкг микрограмм
мкл микролитр
мкмоль микромоль
мг миллиграмм
мл миллилитр
мм миллиметр
ммоль миллимоль
мэкв миллиэквивалент
млн миллион
МПК минимальная подавляющая концентрация
МАО моноаминооксидаза
нг нанограмм
нм нанометр
нмоль наномоль
Na натрий
нед неделя
НПВП нестероидное противовоспалительное средство
ОПСС общее периферическое сосудистое сопротивление
ОЦК объем циркулирующей крови
ОРВИ острая респираторная вирусная инфекция
ОРЗ острое респираторное заболевание
ПАБК пара — аминобензойная кислота
ПАСК пара — аминосалициловая кислота
ПОЛ перекисное окисление липидов
AUC площадь под кривой «концентрация/время»
ПАВ поверхностно — активное вещество
Pg простагландин
РЭС ретикуло — эндотелиальная система
РНК рибонуклеиновая кислота
Pb свинец
СФТ селективная фототерапия
ССС сердечно — сосудистая система
СПИД синдром приобретенного иммунодефицита
SA синоатриальный (-ая)
СКВ системная красная волчанка
СОЭ скорость оседания эритроцитов
СТГ соматотропный гормон
СМЖ спинномозговая жидкость
СНД средняя насыщающая доза
СПД средняя поддерживающая доза
ст. стадия (степень)
сут сутки
т.к. так как
ТТРГ тиреотропного гормона релизинг фактор
ТТГ тиреотропный гормон
т.е. то есть
ТТС трансдермальная терапевтическая система
ТГ триглицериды
УОК ударный объем крови
УЗИ ультразвуковое исследование
УФ ультрафиолетовое
ФСГ фолликулостимулирующий гормон
ФЖЕЛ форсированная жизненная емкость легких
ПУВА — терапия фотохимиотерапия
Cl хлор
ХГ хорионический гонадотропин
ХПН хроническая почечная недостаточность
ХНЗЛ хроническое неспецифическое заболевание легких
ЦНС центральная нервная система
Zn цинк
ч час
ЧСС число сердечных сокращений
ЩФ щелочная фосфатаза
ЭКО экстракорпоральное оплодотворение
ЭКГ электрокардиограмма
ЭЭГ электроэнцефалограмма(графия)
ЭДТА этилендиаминотетраацетат
ЭХОКГ эхокардиограмма
ЯМР ядерно — магнитный резонанс
Жирным шрифтом большего размера выделяется МНН или названия, используемые для группировки препаратов схожего состава.
Жирным курсивом меньшего размера приведены торговые названия препаратов, не имеющих МНН (их описания также напечатаны меньшим шрифтом).
ПРЕДИСЛОВИЕ
Уважаемые коллеги!
Трудно переоценить значение достоверной и объективной информации о лекарственных средствах в обеспечении их эффективного и безопасного использования. Важнейшим условием при этом является наличие официально утвержденной информации о различных аспектах применения лекарственных средств. Это положение предусмотрено законодательством большинства цивилизованных стран, в том числе и требованиями Федерального закона от 22.06.98 N 86-ФЗ «О лекарственных средствах».
Именно поэтому я с особым удовольствием представляю Вам первое издание второго тома Государственного реестра лекарственных средств — «Государственный реестр лекарственных средств (типовые клинико — фармакологические статьи)».
В типовых клинико — фармакологических статьях (ТКФС) обобщены данные о монопрепаратах и их часто используемых комбинациях, полученные в результате клинических исследований и практического опыта медицинского применения лекарственных средств (область применения, типичные противопоказания, побочные эффекты, взаимодействие, фармакокинетика, фармакодинамика, возможные способы введения и пр.).
Реестр является официальным документом и утверждается в установленном порядке. При регистрации новых лекарственных препаратов с активным веществом, на которое уже утверждена ТКФС, информационные материалы на лекарственный препарат должны коррелировать с данными, содержащимися в Реестре.
ТКФС является информационным эталоном для лекарственного препарата, так как включает официально утвержденный минимальный объем сведений, необходимый для эффективного и безопасного его применения.
Во второй том Государственного реестра лекарственных средств включены ТКФС практически на все активные вещества лекарственных средств (за исключением медицинских иммунобиологических препаратов), зарегистрированных в Российской Федерации по состоянию на 1 августа 2000 г.
Государственный реестр типовых клинико — фармакологических статей составлен Научным центром экспертизы и государственного контроля лекарственных средств Министерства здравоохранения Российской Федерации и Фондом фармацевтической информации. Отличительным признаком данного издания является полнота и объективность содержащейся в нем информации, что подтверждается его официальным статусом.
Уверен, что использование сведений, содержащихся в Государственном реестре типовых клинико — фармакологических статей, поможет врачам, провизорам и другим специалистам сферы обращения лекарственных средств лучше ориентироваться в современном многообразии информации о лекарственных средствах, а значит, эффективнее решать профессиональные задачи.
Первый заместитель
Министра здравоохранения
Российской Федерации,
член — корреспондент РАМН
А.И.ВЯЛКОВ
ВВЕДЕНИЕ
Глубокоуважаемые коллеги!
Бурное развитие в последние 15-20 лет фармакологии, органической химии, биотехнологии обусловило появление множества новых лекарственных средств (ЛС), предназначенных для терапии разных патологических состояний. В процессе доклинического изучения и практического применения ЛС постоянно появляются новые сведения о механизме действия, показаниях, противопоказаниях, побочных эффектах ЛС. В результате сформирован значительный массив весьма противоречивой информации о ЛС, что затрудняет проведение рациональной фармакотерапии и решение других задач специалистами, деятельность которых связана с обращением ЛС.
Предлагаемый вашему вниманию второй том «Государственного реестра лекарственных средств (типовые клинико — фармакологические статьи — ТКФС)» содержит официально утвержденную Министерством здравоохранения Российской Федерации информацию о ЛС, разрешенных к медицинскому применению. ТКФС представляют собой совокупность научно обоснованных клинико — фармакологических данных, определяющих эффективность монопрепаратов и/или часто используемых комбинаций ЛС, и включают в себя рациональное химическое название (для комбинированных препаратов указано содержание основных компонентов), сведения о фармакологическом действии, основных фармакокинетических параметрах, показаниях и противопоказаниях к применению, о режиме дозирования, побочных эффектах. В ряде случаев введена рубрика «Особые указания». Чрезвычайно полезной для специалистов здравоохранения является та часть ТКФС, которая обозначена как «Взаимодействие лекарственных средств». В ней изложены основные возможные варианты последствий комбинированного применения ЛС.
ТКФС облегчат деятельность экспертных (Фармакологического и Фармакопейного) комитетов Министерства здравоохранения в части перерегистрации как отечественных, так и зарубежных лекарственных средств. Кроме того, станет более простой оценка препаратов — генериков. В процессе рассмотрения текста новых инструкций на указанные ЛС особое внимание будет уделено их соответствию ТКФС. Станет практически невозможным необоснованное сокращение перечня побочных эффектов и противопоказаний, а также расширение набора показаний к применению ЛС. Любое новое показание необходимо будет утверждать только после серьезных клинических исследований. Указанное обстоятельство позволит, по-видимому, решить проблему разноречивости представляемой информации по тем или иным вопросам применения ЛС.
Реестр ТКФС будет использован при составлении различных списков и перечней ЛС (жизненно важных и необходимых, формулярных, безрецептурных и т.д.).
Составители Реестра (в работе над ТКФС под эгидой Научного центра экспертизы и государственного контроля лекарственных средств Минздрава России участвовали ведущие специалисты в разных областях фундаментальной и клинической медицины, а также фармации) стремились максимально объективизировать информацию о ЛС и облегчить ее восприятие. Они отдают себе отчет в том, что данное издание не могло быть создано без пособия для врачей академика РАМН М.Д. Машковского «Лекарственные средства» (14 издание, 2000 год), учебников и книг академиков РАМН Д.А.Харкевича, П.В.Сергеева, Е.Д.Гольдберга, В.Г.Кукеса, а также ряда других отечественных и зарубежных изданий.
Специалисты, участвовавшие в составлении Реестра, надеются на то, что это издание окажет существенную помощь всем тем, кто участвует в многотрудном процессе рационального применения лекарственных средств, а также с благодарностью воспримут конструктивные критические замечания и предложения, которые помогут сделать Реестр настольной книгой каждого врача и провизора.
Генеральный директор Научного центра
экспертизы и государственного контроля
лекарственных средств Министерства
здравоохранения Российской Федерации,
член — корреспондент РАМН
В.П.ФИСЕНКО
ТИПОВЫЕ КЛИНИКО — ФАРМАКОЛОГИЧЕСКИЕ СТАТЬИ
Абакавира сульфат
Фармакологическое действие. Противовирусное средство из группы нуклеозидных аналогов. Оказывает избирательное действие на ВИЧ-1 и ВИЧ-2 (включая штаммы ВИЧ-1, резистентные к зидовудину, ламивудину, залцитабину, диданозину и невирапину). Ингибируя обратную транскриптазу, приводит к обрыву цепи РНК и прекращению реппликации вируса. Возможное развитие резистентности связано с генотипическими изменениями в определенной кодонной области обратной транскриптазы (кодоны M184V, K65R, L74V и Y115F). Резистентность ВИЧ развивается относительно медленно; необходимы множественные мутации для увеличения концентрации IC50 в 8 раз. Развитие перекрестной резистентности маловероятно. Увеличивает количество CD4 клеток в крови и снижает концентрацию вирусной РНК (в т.ч. в спинномозговой жидкости).
Фармакокинетика. Абсорбция высокая, биодоступность 83%. Cmax 3 мкг/мл, время достижения С max 1-1.5 ч. (после приема внутрь раствора и таблеток, соответственно). AUC (в течение 12 ч. после приема) 6 мкг/ч/мл. Пища замедляет всасывание абакавира и снижает Cmax, но не влияет на AUC. Проникает через ГЭБ, соотношение AUC в спинномозговой жидкости и плазме составляет 30-44%. Связь с белками низкая. Метаболизируется в печени с участием алкогольдегидрогеназы и образованием глюкуронидных конъюгатов (5′-карбоновая кислота и 5′-глюкуронид). Т1/2 1.5 ч. Экскреция почками 83% (в виде метаболитов) и 2% (в неизмененном виде), остальная часть выводится через кишечник.
Показания. ВИЧ — инфекция у взрослых и детей (в составе комбинированной антиретровирусной терапии).
Противопоказания. Гиперчувствительность; детский возраст (до 3 мес.). С осторожностью беременность, период лактации.
Режим дозирования. Внутрь, взрослым и детям старше 12 лет по 300 мг 2 раза в сутки. Детям от 3 мес. до 12 лет 8 мг/кг 2 раза в сутки; максимальная доза 600 мг/сут.
Побочные эффекты. Аллергические реакции, лихорадка, сонливость, быстрая утомляемость, тошнота, рвота, диарея, абдоминальные боли; миалгия, артралгия, одышка, головная боль, парестезии; лимфаденопатия, конъюнктивит, изъязвление слизистой оболочки полости рта; повышение активности «печеночных» трансаминаз, повышение активности КФК, гиперкреатининемия; молочно — кислый ацидоз, гепатомегалия, жировая дистрофия печени (преимущественно у женщин).
Особые указания. В период лечения возможно развитие инфекций, вызываемых условно — патогенными микроорганизмами. Пациентов следует проинформировать о том, что лечение антиретровирусными препаратами не предотвращает риск передачи ВИЧ другим людям при половых контактах или переливании крови, поэтому пациенты должны соблюдать соответствующие меры предосторожности.
Взаимодействие. Не угнетает процессы метаболизма с участием изоферментов CYP3A4, CYP2C9 и CYP2D6. Аддитивное действие в комбинации с диданозином, залцитабином, ламивудином и ставудином. Этанол увеличивает AUC на 41%.
Абисиб
Фармакологическое действие. Средство растительного происхождения, оказывает общетонизирующее, противоязвенное и противовоспалительное действие, ускоряет процессы репаративной регенерации тканей.
Показания. Язвенная болезнь желудка и двенадцатиперстной кишки (в составе комбинированной терапии).
Противопоказания. Гиперчувствительность.
Режим дозирования. Внутрь, по 15 мл 3 раза в
ОФС.1.4.2.0003.15 Извлекаемый объем лекарственных форм для парентерального применения
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Извлекаемый объём ОФС.1.4.2.0003.15
лекарственных форм
для парентерального применения Взамен ст. ГФ XI
Лекарственные формы для парентерального применения могут быть однодозовыми (ампулы, картриджи или заполненные шприцы) или многодозовыми, содержащими несколько доз препарата. Объём лекарственной формы в упаковке должен быть достаточным, чтобы обеспечить введение номинального объёма, указанного на этикетке.
Соответствие лекарственных форм для парентерального применения требованиям по извлекаемому объёму достигается заполнением упаковок с небольшим избытком от номинального объёма (таблица).
Таблица – Объём заполнения инъекционных растворов в однодозовых упаковках
| Номинальный
объём, мл |
Объём заполнения, мл | |
| Невязкие растворы | Вязкие растворы | |
| 0,5 | 0,6 | 0,62 |
| 1,0 | 1,10 | 1,15 |
| 2,0 | 2,15 | 2,25 |
| 5,0 | 5,30 | 5,50 |
| 10,0 | 10,50 | 10,70 |
| 20,0 | 20,60 | 20,90 |
| 30,0 | 30,80 | 31,20 |
| 50,0 | 51,00 | 51,50 |
| Более 50 | На 2 % более номинального | На 3 % более номинального |
Суспензии и эмульсии перед извлечением из упаковки и перед определением плотности встряхивают. Масляные и вязкие лекарственные формы при необходимости можно подогревать в соответствии с указаниями на этикетке. Их следует тщательно встряхивать перед извлечением содержимого. Перед измерением объёма содержимое охлаждают до 20 — 25 °С.
Однодозовые лекарственные формы
Отбирают 5 упаковок, если номинальный объём менее 10 мл, или 3 упаковки, если номинальный объём составляет 10 мл и более. Извлекают всё содержимое каждой отобранной упаковки, используя сухой шприц, вместимость которого не более чем в 3 раза превышает измеряемый объём, снабженный подходящей иглой длиной не менее 2,5 см. Из шприца и иглы удаляют пузырьки воздуха и помещают содержимое, не выдавливая содержимое из иглы, в сухой мерный цилиндр, калиброванный на заполнение. Вместимость мерного цилиндра должна быть такой, чтобы измеряемый объём занимал не менее 40 % от номинального объёма цилиндра. Альтернативно объём содержимого в миллилитрах может быть рассчитан как отношение массы содержимого в граммах к плотности.
Для упаковок с номинальным объёмом 2 мл и менее содержимое нескольких упаковок может быть объединено, чтобы получить объём, подходящий для измерения, при условии, что для каждой упаковки используется отдельный сухой шприц. Содержимое упаковок с номинальным объёмом
50 мл или более может быть определено непосредственным выливанием в мерный цилиндр или сухой предварительно взвешенный бюкс.
Объём содержимого упаковки должен быть не менее номинального, если упаковки исследуются индивидуально. Для упаковок с номинальным объёмом 2 мл и менее измеренный объём должен быть не менее суммы номинальных объёмов исследованных упаковок.
Многодозовые лекарственные формы
Для многодозовых лекарственных форм для парентерального применения в упаковках, на которых указано количество доз определенного объёма, выбирают одну упаковку и поступают, как указано для однодозовых лекарственных форм, используя то же количество отдельных шприцев, что и количество указанных доз.
Измеренный объём должен быть таким, чтобы объём, извлекаемый из каждого шприца, обеспечивал дозу не менее заявленной.
Картриджи и заполненные шприцы
Отбирают 5 упаковок. При необходимости снабжают упаковку аксессуарами, необходимыми для использования (игла, поршень, шприц) и извлекают всё содержимое каждой отобранной упаковки, не выдавливая содержимое из иглы, в сухой предварительно взвешенный бюкс, медленно и постоянно нажимая на поршень. Взвешивают бюкс и рассчитывают объём в миллилитрах как отношение массы в граммах к плотности.
Объём, полученный для каждой исследованной упаковки, должен быть не менее номинального.
Инфузионные растворы
Отбирают одну упаковку. Переносят содержимое в сухой мерный цилиндр, калиброванный на заполнение, вместимость которого должна быть такой, чтобы лекарственная форма занимала не менее 40 % от номинального объёма цилиндра. Измеряют объём.
Объём должен быть не менее номинального.
Скачать в PDF ОФС.1.4.2.0003.15 Извлекаемый объем лекарственных форм для парентерального применения
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Осипова И.Г. 1 Евлашкина В.Ф. 1 Давыдов Д.С. 1 Саканян Е.И. 1 1 ФГБУ «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации Увеличение номенклатуры пробиотиков и их широкое применение в клинической практике послужило основанием к разработке ОФС на пробиотики для медицинского применения и методы их испытаний, предназначенные для включения в ГФ РФ (XIII изд.). Для создания единой системы оценки качества пробиотиков (отечественных и зарубежных) были проанализированы требования нормативной документации к качеству препаратов пробиотиков, находящихся в обращении на территории Российской Федерации и включенных в Государственный реестр ЛС РФ. В настоящее время в России зарегистрировано более 50 препаратов пробиотиков в различных лекарственных формах. В процессе проведенного исследования была осуществлена стандартизация используемых терминов, создана система разделения препаратов пробиотиков на группы, разработаны унифицированные требования к основным показателям качества, методам испытаний, отбору производственных штаммов, валидации методов испытаний и т.д. Материалы выполненных исследований использованы при составлении десяти ОФС («Пробиотики», «Бифидосодержащие пробиотики», «Лактосодержащие пробиотики», «Колисодержащие пробиотики», «Споровые пробиотики», «Иммунобиологические лекарственные средства», «Безопасность пробиотиков для медицинского применения», «Микробиологическая чистота», «Специфическая активность пробиотиков для медицинского применения» и «Производственные штаммы и штаммы для контроля»), вошедших в ГФ РФ XIII издания.
 1796 KB общая фармакопейная статья пробиотик для медицинского применения производственный штамм методы испытания показатели качества 1. Федеральный закон Российской Федерации от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств». 2. Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года. Available from: http://www.realschool.ru/data/library/statia.pdf; http://fas.gov.ru/upload/ aboutfas/archive/dcd6e0324412 e43ebe3c2f165ca4717b. pdf. 3. Государственный реестр лекарственных средств Российской Федерации. // URL: http://grls.rosminzdrav.ru/ 4. Lilly D.M., Stillwell R.H. Probiotics: Growth promoting factors produced by microorganisms//Science. – 1965. – 147. – P. 747–748. 5. FAO/WAO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Argentina, 2001. Available from: http://www.fao.org/es/esn/Probio/report.pdf. 6. Чупринина Р.П., Скорикова (Осипова) И.Г., Евлашкина В.Ф. Препараты для профилактики и лечения дисбактериозов различной этиологии // В монографии: «Актуальные проблемы создания и применения иммунологических препаратов для диагностики и профилактики инфекционных болезней. – Пермь, 1993. – Т. 1. – С. 264–279 7. Государственная фармакопея РФ, изд.ХIII / Т. 1, 2 http://www.femb.ru/feml
1796 KB общая фармакопейная статья пробиотик для медицинского применения производственный штамм методы испытания показатели качества 1. Федеральный закон Российской Федерации от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств». 2. Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года. Available from: http://www.realschool.ru/data/library/statia.pdf; http://fas.gov.ru/upload/ aboutfas/archive/dcd6e0324412 e43ebe3c2f165ca4717b. pdf. 3. Государственный реестр лекарственных средств Российской Федерации. // URL: http://grls.rosminzdrav.ru/ 4. Lilly D.M., Stillwell R.H. Probiotics: Growth promoting factors produced by microorganisms//Science. – 1965. – 147. – P. 747–748. 5. FAO/WAO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Argentina, 2001. Available from: http://www.fao.org/es/esn/Probio/report.pdf. 6. Чупринина Р.П., Скорикова (Осипова) И.Г., Евлашкина В.Ф. Препараты для профилактики и лечения дисбактериозов различной этиологии // В монографии: «Актуальные проблемы создания и применения иммунологических препаратов для диагностики и профилактики инфекционных болезней. – Пермь, 1993. – Т. 1. – С. 264–279 7. Государственная фармакопея РФ, изд.ХIII / Т. 1, 2 http://www.femb.ru/feml
Создание качественных, эффективных и безопасных лекарственных средств (ЛС) является основной задачей современной фармацевтической науки и практики. Любая национальная фармакопея устанавливает стандарты качества ЛС данной страны, являясь наглядным индикатором уровня развития и состояния национальной фармацевтической науки и промышленности. Отечественная система стандартизации ЛС базируется на Государственной Фармакопее Российской Федерации (ГФ РФ), включающей в себя общие фармакопейные статьи (ОФС) и фармакопейные статьи (ФС). Согласно Федеральному Закону № 61-ФЗ «Об обращении лекарственных средств» от 12 апреля 2010 года «качество лекарственного средства – это соответствие лекарственного средства требованиям фармакопейной статьи, либо в случае её отсутствия нормативной документации или нормативного документа» . Требования ГФ обязательны для всех организаций, занимающихся на территории РФ производством, изготовлением, хранением и применением лекарственных средств. Статьи ГФ РФ используются предприятиями – производителями лекарственных средств, как основа для создания собственной нормативной документации, которая в последующем применяется в экспертизе и контроле качества лекарственных средств на всех этапах их жизненного цикла .
В настоящее время, в соответствии с Государственным Реестром лекарственных средств (ГРЛС РФ), в Российской Федерации зарегистрировано более 50 препаратов пробиотиков, представленных в различных лекарственных формах (ЛФ) . Увеличение номенклатуры пробиотиков потребовало создания фармакопейных стандартов качества и унификации требований, предъявляемых к их структуре и содержанию.
Целью данного исследования явилось создание фармакопейных стандартов качества лекарственных препаратов пробиотиков, основанных на современных научных достижениях и требованиях отечественных регламентирующих документов. В зарубежных фармакопеях данная группа лекарственных препаратов не выделена в категорию ЛС и монографии на них отсутствуют. В связи с этим, проведение анализа аналогичных монографий ведущих зарубежных фармакопей не представлялось возможным.
Разработка ОФС на лекарственные пробиотики и методы их анализа требовала решения нескольких задач:
– унификация используемых терминов и создание системы классификации на группы препаратов (т.к. без унификации терминологической системы невозможно однозначное понимание регламентируемых стандартов и положений);
– анализ требований, предъявляемых к показателям качества, нормативным требованиям, методам и методикам, условиям проведения испытаний препаратов пробиотиков.
Несмотря на давность введения термина «пробиотики» до настоящего времени продолжаются научные дискуссии, касающиеся правомерности его применения наряду с термином, также используемым в нашей стране – «эубиотики» (или «бактерийные препараты нормофлоры»). Под термином «пробиотик» понимают «препарат на основе живых и убитых микроорганизмов и веществ микробного происхождения, оказывающих позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры» . «Эубиотики – это бактерийные препараты, действующим началом которых являются живые культуры микроорганизмов – представителей нормальной микрофлоры» . Таким образом, терминами «пробиотики» и «эубиотики» изначально обозначали лекарственные препараты, содержащие бактерии, входящие в состав нормальной микрофлоры человека. На протяжении последних лет данные термины использовались как синонимы. Это объясняется тем, что в состав подавляющего большинства пробиотиков изначально входили бактерии нормальной микрофлоры человека. Вместе с тем, понятие «пробиотики» более широкое. В настоящее время в состав препаратов пробиотиков входят бациллы, энтерококки, грибы, в связи, с чем использование по отношению к их наименованию понятия «пробиотик» правильнее. Эубиотики, по своей сути согласно современным представлениям, следует рассматривать как частную разновидность пробиотиков, поэтому в ОФС, включенной в ГФ РФ XIII издания, используется термин «пробиотики для медицинского применения» с указанием о том, что пробиотики содержат живые и инактивированные апатогенные микроорганизмы и/или продукты их метаболизма вместе с частично разрушенными микробными клетками, обладающими антагонистической активностью в отношении патогенных и условно-патогенных бактерий и обеспечивающими восстановление нормальной микрофлоры человека .
Традиционно пробиотики классифицируют на группы по составу или по названию таксономических групп микроорганизмов.
По составу пробиотики подразделяют на монокомпонентные, поликомпонентные, сорбированные и комбинированные. Система классификации основана на содержании в составе в качестве активного компонента одного («моно») или нескольких («поли») штаммов/видов/родов микроорганизмов; вспомогательных веществ сорбентов – активированный угль, кремния диоксид коллоидный и т.п.), (в этом случае пробиотик называется «сорбированным») или лизоцима, лекарственных средств растительного происхождения, витаминов/микроэлементы и др. (такой пробиотик называется комбинированным). Основные недостатки этой классификации состоят в том, что препараты, входящие в одну группу отличаются по основным показателям («Подлинность», «Специфическая активность», «Количество живых бактерий в одной дозе» и «Отсутствие посторонних микроорганизмов и грибов»/»Микробиологическая чистота») и нормативным требованиям. Например, в группу «монокомпонентных пробиотиков» входят препараты Бифидумбактерин и Споробактерин, у которых разные показатели специфической активности, в первом случае «Активность кислотообразования», а во втором – «Антагонистическая активность». Кроме того показатели качества «Количество живых бактерий в одной дозе» и «Отсутствие посторонних микроорганизмов и грибов/Микробиологическая чистота» также контролируют разными методами, т.к. данные препараты содержат анаэробные и аэробные бактерии, которые требуют различных условий культивирования.
Другая система классификации основана на делении по таксономическим группам микроорганизмов: «бифидосодержащие пробиотики», «лактосодержащие пробиотики», «колисодержащие пробиотики», «споровые пробиотики» и «пробиотики других таксономических групп (содержат живые апатогенные бактерии, принадлежащие к родам Leuconostoc, Pediococcus, Propionibacterium, Aerococcus, Enterococcus, дрожжевых грибов – Saccharomyces сerevisiae и S.boulardii)». Этой системой классификации учитываются основные свойства активного компонента. Препараты, входящие в одну группу не отличаются по показателям качества, отличия в нормативных требованиях незначительны. В связи с этим система деления по таксономическим группам микроорганизмов была взята за основу. Для четырех групп пробиотиков были разработаны общие фармакопейные статьи .
Требования к перечню показателей качества, включаемых в фармакопейную статью и/или нормативную документацию на лекарственные препараты, складывается из требований к лекарственной форме, в которой данный препарат выпускается, и биологических свойств активного компонента. Для создания единой системы оценки качества пробиотиков (отечественных и зарубежных) были проанализированы требования нормативной документации на препараты, внесенные в ГРЛС РФ . Проведенный анализ показал, что пробиотики применяются с использованием различных путей введения: для приема внутрь, интравагинально, ректально. При этом они препараты пробиотиков могут быть в виде различных ЛФ (лиофилизаты, суспензии, порошки, таблетки, ректальные и вагинальнын суппозитории и др.). Показатели качества, включенные в ОФС на пробиотики , с соответствующими ссылками на ОФС представлены в табл. 1.
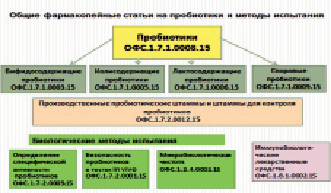
Схема распределения общих фармакопейных статей на препараты пробиотиков и методы испытаний, включенные в ГФ РФ, изд. XIII
Таблица 1
Показатели качества и методы их определения, включенные в общие фармакопейные статьи
|
Название показателя |
Ссылка на нормативный документ или метод испытания |
|
Описание |
Визуальный |
|
Подлинность |
ОФС.1.7.2.0009.15 «Определение специфической активности пробиотиков» |
|
Время восстановления (для лиофилизатов, порошков) |
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» |
|
Время распадаемости (для таблеток и капсул) |
ОФС1.4.2.0013.15 «Распадаемость таблеток и капсул» |
|
Температура и время плавления или время полной деформации (для суппозиториев) |
ОФС.1.2.1.0012.15 «Температура плавления» или ОФС1.4.2.0010.15 «Определение времени полной деформации суппозиториев на липофильной основе» |
|
рН |
ОФС.1.2.1.0004.15 «Ионометрия» |
|
Потеря в массе при высушивании |
ОФС.1.2.1.0010.15 «Потеря в массе при высушивании» |
|
Средняя масса и отклонения от средней массы (для таблеток, суппозиториев, содержимого капсул, пакетов) |
ОФС.1.4.2.0009.15 «Однородность массы дозированных лекарственных форм» |
|
Извлекаемый объем (для суспензий) |
ОФС.1.4.2.0002.15 «Извлекаемый объем» |
|
Специфическая безвредность |
ОФС.1.7.2.0001.15 «Безопасность пробиотиков в тестах in vivo» |
|
Отсутствие посторонних микроорганизмов и грибов |
ОФС.1.2.4.0002.15 «Микробиологическая чистота» |
|
Специфическая активность |
ОФС.1.7.2.0009.15 «Определение специфической активности пробиотиков» |
|
Производственные штаммы и штаммы для контроля |
ОФС.1.7.2.0012.15 «Производственные пробиотические штаммы и штаммы для контроля пробиотиков» |
|
Упаковка и Маркировка |
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» |
|
Хранение |
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» |
Контроль обязательных показателей качества пробиотиков «Подлинность», «Специфическая активность», «Отсутствие посторонних микроорганизмов и грибов» и «Специфическая безвредность» включает в себя биологические и микробиологические методы, которые характеризуются более высокой степенью вариабельности, чем физико-химические, что явилось необходимостью к разработке общих фармакопейных статей на используемые методы испытаний.
ОФС 1.7.2.0009.15 «Определение специфической активности пробиотиков» вводится впервые и включает валидированные методы определения показателей качества «Количество жизнеспособных бактерий в одной дозе лекарственного средства», «Активность кислотообразования» или «Антагонистическая активность». Определение количества живых особей в дозе проводят методом десятикратных разведений с высевом на плотные питательные среды (метод Коха) и глубинного чашечного метода или в жидкие и полужидкие среды (метод предельных разведений). При проведении контроля поликомпонентных или комбинированных пробиотиков необходимо учитывать количество и соотношение всех видов или штаммов входящих в препарат. Результаты количественного определения микроорганизмов выражаются в колониеобразующих единицах (КОЕ). Кислотообразующую активность штаммов-продуцентов, входящих в лакто- и бифидосодержащие пробиотики определяют по титруемой кислотности при культивировании бактерий в адекватной питательной среде, методом кислотно-основного титрования. Для определения антагонистической активности используют метод отсроченного антагонизма на плотной среде по зонам задержки роста тест-штаммов патогенных и условно-патогенных микроорганизмов. Тест-штаммы микроорганизмов, получают из Государственной коллекции патогенных микроорганизмов ФГБУ «НЦ ЭСМП» Министерства здравоохранения РФ (если нет других указаний в фармакопейной статье или нормативной документации).
ОФС.1.7.2.0001.15 «Безопасность пробиотиков в тестах in vivo» вводится впервые и содержит валидированные биологические методы, используемые в опытах in vivo, предназначенные для определения следующих показателей: «Безвредность», «Вирулентность», «Токсичность», «Токсигенность», позволяющих выявлять недопустимые реакции человеческого организма на применение лекарственного средства и отсутствие риска причинения вреда здоровью. Контроль пробиотика по показателю «Безвредность» позволяет выявить негативное воздействие испытуемого препарата при вероятном образовании токсических примесей (например, при нарушении производственного регламента, нарушениях условий хранения и т.п.). Испытание безвредности препарата пробиотика осуществляют при его пероральном введении беспородным белым мышам в количестве, не превышающем одной человеческой дозы. Показатели «Вирулентность», «Токсичность» и «Токсигенность» являются обязательными при контроле безопасности производственных штаммов бактерий рода Escherichia coli, Bacillus, Leuconostoc, Pediococcus, Propionibacterium, Aerococcus, Enterococcus, дрожжевых грибов – Saccharomyces сerevisiae, S.boulardii и др. микроорганизмов. Целью проведения данных тестов является выявление возможной патогенности испытуемых штаммов, превышающей установленный ранее допустимый уровень, что может контролироваться по летальности или интоксикации тестируемых животных.
В ОФС.1.2.4.0002.15 «Микробиологическая чистота» впервые включен раздел «Определение микробиологической чистоты иммунобиологических лекарственных средств, содержащих живые микроорганизмы», в котором впервые указаны категории микробной чистоты различных ЛФ пробиотиков (табл. 2), методы определения отсутствия контаминации препаратов пробиотиков посторонними микроорганизмами и грибами.
Таблица 2
Микробиологическая чистота пробиотиков
|
ПРОБИОТИКИ |
Категория 5.3 |
|
ЛФ |
Рекомендуемые требования |
|
А. Для приема внутрь, интравагинально (лиофилизаты, суспензии, порошки) |
– Отсутствие бактерий-контаминантов в единице препарата/г(мл) – Отсутствие дрожжевых и плесневых грибов в единице препарата/г(мл) – Для колисодержащих препаратов – отсутствие в единице препарата/г(мл) БОЕ бактериофага (для препаратов с содержанием E.coli не менее 1010 КОЕ допускается не более 10 БОЕ бактериофага) |
|
Б. Для приема внутрь, интравагинально, ректально (таблетки, капсулы, суппозитории) |
– Общее число аэробных бактерий – не более 102 КОЕ в единице препарата (г) – Общее число дрожжевых и плесневых грибов – менее 10 КОЕ в единице препарата (г) – Отсутствие энтеробактерий в единице препарата (г) – Отсутствие Pseudomonas aeruginosa в единице препарата (г) – Отсутствие Staphylococcus aureus в единице препарата (г) – Для колисодержащих препаратов – отсутствие в единице препарата (г) БОЕ бактериофага (для препаратов с содержанием E.coli не менее 1010 КОЕ допускается не более 10 БОЕ бактериофага) |
Раздел этой ОФС «Определение микробиологической чистоты иммунобиологических лекарственных средств, содержащих живые микроорганизмы» построен следующим образом: «Питательные среды, используемые в испытаниях», «Отбор и подготовка испытуемых образцов», таблицы с указанием условий проведения испытаний, «Методика», «Учет результатов».
ОФС.1.7.2.0012.15 «Производственные пробиотические штаммы и штаммы для контроля пробиотиков» вводится впервые и распространяется на штаммы микроорганизмов, используемые в производстве пробиотиков для медицинского применения . В ОФС указано, что для производства ЛП должны использоваться пробиотические производственные штаммы микроорганизмов с терапевтическим действием, подтвержденным клинически, депонированные в Национальной или Международной коллекции. Кроме того, в ОФС изложены требования к отбору, проверке и хранению рекомендуемых штаммов микроорганизмов, а также к биологическим свойствам тест-штаммов микроорганизмов, рекомендуемых для контроля антагонистической активности производственных штаммов и лекарственных препаратов пробиотиков.
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» вводится впервые и содержит требования, предъявляемые к производству, исходному сырью, штаммам, показателям качества, упаковке, маркировке, условиям транспортирования и хранения иммунобиологических препаратов, включая препараты пробиотиков .
Заключение
Разработка фармакопейных требований к оценке качества препаратов пробиотиков обеспечивает комплексный подход к вопросам их стандартизации, основанных на национальных требованиях, сформированных с учетом системы обеспечения качества лекарственных средств в РФ. Материалы выполненных исследований включены в десять ОФС («Пробиотики», «Бифидосодержащие пробиотики», «Лактосодержащие пробиотики», «Колисодержащие пробиотики», «Споровые пробиотики», «Иммунобиологические лекарственные средства», «Безопасность пробиотиков для медицинского применения», «Микробиологическая чистота», «Специфическая активность пробиотиков для медицинского применения» и «Производственные штаммы и штаммы для контроля»), вошедших в ГФ РФ XIII издания.
Библиографическая ссылка
Осипова И.Г., Евлашкина В.Ф., Давыдов Д.С., Саканян Е.И. ОБЩИЕ ФАРМАКОПЕЙНЫЕ СТАТЬИ НА ПРЕПАРАТЫ ПРОБИОТИКИ ДЛЯ ГОСУДАРСТВЕННОЙ ФАРМАКОПЕИ РФ XIII ИЗДАНИЯ – ПЕРВЫЙ ОПЫТ В МИРОВОЙ ФАРМАКОПЕЙНОЙ ПРАКТИКЕ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 6-2. – С. 272-276;
URL: https://applied-research.ru/ru/article/view?id=9595 (дата обращения: 10.12.2019). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
технология вопросы экзамен вопросы 33,34
33.Что представляет собой Государственная фармакопия, общие и частные фармакопейные статьи.
Фармакопе́я (с др.-гр. φαρμακον — лекарство, яд и др.-гр. ποιη — делаю, изготовляю) — сборник официальных документов (свод стандартов и положений), устанавливающих нормы качества лекарственного сырья — медицинских субстанций, вспомогательных веществ, диагностических и лекарственных средств и изготовленных из них препаратов.
Положения фармакопеи основаны на достижениях фармацевтической химии и ее фармацевтического анализа, его критериев, способов и методов. Этот документ включает указания по изготовлению, проверке качества лекарств. Определяет высшие дозы препаратов и устанавливает требования к лекарственному сырью. Выполнение изложенных норм и требований Фармакопеи в сочетании с исполнением требований стандарта GMP обеспечивает надлежащее качество лекарственных субстанций и препаратов.
Государственная фармакопея — фармакопея, находящаяся под государственным надзором. Государственная фармакопея является документом общегосударственной законодательной силы, его требования обязательны для всех организаций данного государства, занимающихся изготовлением, хранением и применением лекарственных средств, в том числе растительного происхождения.
Она содержит:
описания методов химических, физико-химических и биологических анализов лекарственных средств,
сведения о необходимых для этого реактивах и индикаторах,
описания статей на отдельные лекарственные субстанции и лекарственные препараты,
списки ядовитых (список А) и сильнодействующих (список Б) лекарств,
таблицы высших разовых и суточных доз для взрослых и детей.
Первая Фармакопея России («Pharmacopoea Rossica») вышла в 1778 году.
В последующие годы на русском языке были выпущены следующие издания Фармакопеи: второе в 1871 году, третье — 1880, четвёртое — 1891, пятое — 1902, шестое — 1910, седьмое — 1925, восьмое — 1946, девятое — 1961, десятое — 1968, одиннадцатое — 1987 (первый выпуск) и 1990 — (второй выпуск).
1 часть «Государственной Фармакопеи Российской Федерации XII издания» была выпущена в феврале 2008 года, с 2009 года она введена в действие. Теперь продолжается работа над выпуском второй части.
Составление, дополнение и переиздание Фармакопеи ранее осуществлялось фармакопейным комитетом. В настоящее время Фармакопею готовит редакционный совет, в который входят представители Минздравсоцразвития, Росздравнадзора, Росздрава, ФФОМС и ведущие российские учёные.
Фармакопейная статья (ФС) — это нормативно-технический документ, устанавливающий требования к качеству лекарственного средства или лекарственного растительного сырья, его упаковке, условиям и сроку хранения, методам контроля качества, утверждаемый уполномоченным федеральным органом исполнительной власти и носящий характер государственного стандарта.
Фармакопейная статья содержит: название лекарственного растительного сырья как на русском так и на латинском языках (при этом латинское название лекарственного сырья выполняет функцию международного названия)
Фармакопейные статьи (виды):
Фармакопейная статья предприятия (ФСП):
— это стандарт качества лекарственного средства под торговым названием, содержит перечень методов и показателей контроля качества лекарственного средства производства конкретного предприятия, учитывается конкретная технология данного предприятия, прошедшая экспертизу и регистрацию в установленном порядке в соответствии с Государственной Фармакопеей, фармакопейных статей настоящих стандартов, при это показатели качества, должны быть не ниже требований, находящихся в Государственной Фармакопее.
Срок действия фармакопейной статьи (фармстатьи) предприятия устанавливается при ее утверждении, не более чем на 5 лет, при этом учитывается уровень технологического процесса конкретного производства лекарственного средства.
Общая фармакопейная статья (ОФС):
— это государственный стандарт качества лекарственного средства, содержащит основные требования к лекарственной форме, а так же описание стандартных методов контроля качества лекарственных средств. Общая фармакопейная статья включает в себя: перечень нормируемых показателей и методы испытания для конкретной лекарственной формы, описание химических, физических, физико-химических, биологических, биохимических, микробиологических методов анализа лекарственных средств, сюда же входят требования к используемым титрованным растворам, реактивам, индикаторам.
Фармакопейная статья, общая фармакопейная статья и фармакопейная статья предприятия утверждаются руководителем Департамента, а после регистрируются в организации, уполномоченной Министерством Здравоохранения Российской федерации, с обязательным присвоением обозначения.
Частная фармакопейная статья (ЧФС):
— это нормативно-технический документ, регламентирующий качество и безопасность лекарственного средства, создается частная фармакопейная статья для лекарственного средства под международным непатентованным названием (если оно имеется, или же под наименованием, которое заменяет его в обязательном установленном порядке, сюда же входит перечень нормируемых показателей и методики испытания данного лекарственного средства, а также же ссылки на общие фармакопейные статьи.
Временная фармакопейная статья:
– это нормативно-технический документ, утверждаемый на период освоения промышленного выпуска лекарственного средства и для отработки промышленной технологии методов определения качества или показателей нового лекарственного средства на срок не более 3 лет.
Структура фармакопейной статьи:
Вводная часть. В вводной части (преамбуле) указывается:
— время сбора сырья (фаза вегетации, иногда календарный срок) и о6язательно приводится характеристика сырья по режиму его технологической обработки:
— высушенное, обмолоченное, свежесобранное, свежезамороженное и т.д.;
— дикорастущее или культивируемое растение;
— его жизненная форма;
— название производящего растения и семейства на русском языке и латыни.
Внешние признаки. Важнейший показатель подлинности и чистоты сырья. В этом разделе указывается:
— состав сырья;
— характерные диагностические признаки, характерные запах и вкус (для не ядовитых видов), размеры сырья.
Микроскопия. Важнейший метод определения подлинности лекарственного сырья. Раздел содержит:
— диагностические признаки анатомического строения сырья (для некоторых видов приводится люминесцентная микроскопия);
— вид микропрепарата, на котором проводится исследование.
Качественные реакции. В разделе приводятся собственно качественные, гистохимические реакции, или хроматографические пробы подлинности, на основные группы действующих веществ, методика их выполнения и результаты.
Числовые показатели. В раздел включены специфические показатели и их нормы:
— для цельного, резаного или порошковидного сырья, которые являются стандартом для всех видов лекарственного растительного сырья и определяют его качество;
— содержание действующих или экстрактивных веществ, золы общей и золы нерастворимой в 10% растворе хлористоводородной кислоты, примесей и измельченности.
Количественное определение. Приводится методика количественного определения основных действующих веществ в виде суммарного содержания, в пересчете на какое-либо вещество, содержащееся в данном сырье. В случае, если выделяется индивидуальное вещество (например, платифиллин и пр.), нормируют содержание именно этого компонента в сырье. Если методика количественного анализа изложена в ГФ XI выпуск I, то в частной фармакопейной статье приводится ссылка на нее.
Упаковка. Указаны виды упаковки и масса сырья в единице упаковки.
Микробиологическая чистота. Метод определения микроорганизмов и их допустимые пределы.
Маркировка. Приводится в соответствии с требованиями к графическому оформлению лекарственных средств.
Транспортирование. При необходимости указываются требования к погрузке, выгрузке продукции, обращению с ней после транспортирования.
Хранение. Указываются условия хранения продукции, в том числе требования по защите продукции от влияния климатических факторов.
Срок годности. Время, в течение которого лекарственное сырье может быть использовано.
Фармакологическое действие. Фармакологическая группа, к которой отнесено лекарственное сырье.
34. Основы для мазей, классификация и характеристика
Мази-это мягкая лекарственная форма, предназначенная для нанесения на кожу, раны, слизистые оболочки, состоящие из мазевой основы и распределенных в ней лекарственных веществ.
Требования к мазям:
1.должны иметь мягкую консистенцию, обеспечивающую удобство нанесения на кожу и слизистую
2.максимальное диспергирование лек в-в и равномерное распределение их по всей мази(однородность)
3.стабильность при хранении
4.отсутствие механических включений
5.не должны менять своего состава при хранении и применении
6.не должны расслаиваться при хранении
7.не должны быть токсическими и аллергенными для кожи
8.для глазных мазей,для введения в полость тела,для новорожденных, с антибиотиками – стерильность
9.отсутствие отрицательных взаимодействий между лек веществами и вспомогательными
В состав мази входит:
1.мазевая основа ( ланолин, вазелин)
2. лек. В-во(оксид цинка, сера, дерматол, новокаин, протаргол, анестезин, ментол, камфора, фурацилин, сульфациламиды)
Классификация мазей:
1.по составу: а)простая
Б)сложная
2. по характеру действия:
А)поверхностного
Б)глубокого
3.по месту назначения:
А)глазная
Б)для носа и др.
4.по консистенции:
А)линимент (лек. Форма для наружного применения, представляющая собой густые, жидкие или студнеобразные массы, растворяющиеся при температуре тела. С физико-химической точки зрения это дисперсионная система с различной степенью дисперстности и гомогенности)
Б)паста (мази с % порошка 25 и более, суспензионного и комбинированного типа,труднее намазываются,но дольше действуют и удерживаются на коже)
В)крем
Г)мазь
5.по типу дисперстной системы:
А)гомогенные(однофазная)(мази-сплавы (сочетание взаиморастворимых плавких компонентов),мази-растворы (образованы веществами, растворимыми в основе – если основа вазелин, то гомогенные мази образуют: камфора,ментол,фенол),экстракционные(получаются путем экстакции маслами сырья растительного/животного происхождения))
Б)гетерогенные(двухфазная)(мази-суспензии(основная задача при приготовлении-как можно более тонкое измельчение твердого в-в),мази-эмульсии(в составе ЛВ, растворимые в воде,но нерастворимые в основе(протаргол,новокаин,колларгол,эфедрина гидрохлорид),водные растворы ЛВ и фармакопейные жидкости(р-р Адреналина, жид. Бурова),вязкие жидкости(ихтиол,деготь),комбинированные(содержат в составе вещества,образующие разные типы мазей,но готовится такая мазь в одной ступке!))
Чаще всего в аптеках изготавливают комбинированные мази.
Стандартизация лекарственных средств. Фармакопейные статьи, их виды.
Стандартизация лекарственных средств является, как правило, основным гарантом их высокого качества при серийном производстве и обеспечивает эффективность и безопасность применения. Управление качеством достигается путем осуществления совокупности мероприятий, методов и средств, которые обеспечивают и поддерживают качество продукции. Стандартизация решает следующие основные задачи: разработка нормативных требований к качеству готовой продукции, а также к качеству сырья, полуфабрикатов, используемых при ее изготовлении; разработка требований и норм в области проектирования и производства продукции, методов и средств ее испытания и контроля; обеспечение единства и правильности измерений в стране, разработка новых и совершенствование существующих эталонов единиц измерений; Фармакопейная статья (ФС) — это нормативно-технический документ, устанавливающий требования к качеству лекарственного средства или лекарственного растительного сырья, его упаковке, условиям и сроку хранения, методам контроля качества, утверждаемый уполномоченным федеральным органом исполнительной власти и носящий характер государственного стандарта. Фармакопейные статьи (виды): Фармакопейная статья предприятия (ФСП) — это стандарт качества лс под торговым названием, содержит перечень методов и показателей контроля качества лс производства конкретного предприятия, учитывается конкретная технология данного предприятия, прошедшая экспертизу и регистрацию в установленном порядке в соответствии с Государственной Фармакопеей. Общая фармакопейная статья (ОФС):— это государственный стандарт качества лс, содержащий основные требования к лекарственной форме, а так же описание стандартных методов контроля качества лекарственных средств. Фармакопейная статья, общая фармакопейная статья и фармакопейная статья предприятия утверждаются руководителем Департамента, а после регистрируются в организации, уполномоченной Министерством Здравоохранения Российской федерации, с обязательным присвоением обозначения. Частная фармакопейная статья (ЧФС):— это нормативно-технический документ, регламентирующий качество и безопасность лекарственного средства, создается частная фармакопейная статья для лекарственного средства под международным непатентованным названием. Временная фармакопейная статья: – это нормативно-технический документ, утверждаемый на период освоения промышленного выпуска лекарственного средства и для отработки промышленной технологии методов определения качества или показателей нового лекарственного средства на срок не более 3 лет.
14.Основные разделы ФС на примере фармацевтической субстанции.
Фармацевтическая субстанция– стандартизованное биологически активное вещество или стандартизованная смесь биологически активных веществ, полученные методами синтеза или с применением биологических, молекулярно — генетических или клеточных технологий, предназначенные для приготовления лекарственных препаратов.
Многие субстанции представляют собой соли органических кислот и органических оснований. Названия фармакопейных статей на такие субстанции должно включать название и катиона, и аниона. Например, Натрия диклофенак, Калия диклофенак или Амлодипина бесилат или Доксазозина мезилат или Кетамина гидрохлорид. Названия субстанций, являющихся по своей химической природе сложными эфирами, пишутся слитно.Например, Бекламетазондипропионат, а не Бекламетазона дипропионат или Бетаметазонвалерат, а не Бетаметазона валерат.
Во вводной части фармакопейной статьи на субстанцию приводят химическое название по номенклатуре JUPAC, структурную формулу, эмпирическую формулу и относительную молекулярную массу.
Описание. Указывают характеристики физического состояния и цвет субстанции. Не следует включать описание вкуса. В необходимых случаях приводят информацию о запахе и гигроскопичности.
Для твердых субстанций необходимо указание «кристаллический», «мелкокристаллический» или «аморфный порошок». Характеристика кристалличности субстанции является одним из важных параметров, от которого зависит качество твердых дозированных лекарственных форм.
В некоторых случаях может быть указан численный диапазон размера частиц, а также введено исследование формы кристаллов. Такие испытания выносят в отдельные разделы.
Оценка полиморфизма субстанции обязательна в тех случаях, когда полиморфная модификация определяет фармакологическую активность готовой лекарственной формы и ее фармако-технологические свойства.
Растворимость. Для определения растворимости следует использовать растворители, охватывающие широкую шкалу полярности, например: вода, 96 % спирт, ацетон, гексан. Не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или очень токсичных (например, бензол) растворителей.
Подлинность. Для установления подлинности субстанции рекомендуется оптимальное сочетание физико-химических и химических методов – инфракрасной спектроскопии, абсорбционной спектрофотометрии, тонкослойной, газовой и высокоэффективной жидкостной хроматографии (ТСХ, ГХ и ВЭЖХ) и качественных (в первую очередь специфических) химических реакций.
Температура плавления. Испытание обычно применяют для характеристики твердых веществ.